下列反应中生成物的总能量高于反应物的总能量的是 ( )
| A.氢氧化钠溶液与盐酸中和 | B.铝粉与氧化铁反应 |
| C.乙炔的燃烧 | D.碳酸氢钠受热分解 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ()
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1 |
| C.SO42-、NH4+一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
下列叙述或表示方法正确的是()
| A.Na2O2是离子化合物,其阴、阳离子个数比为1∶1 |
B.N(NO2)3(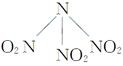 )既有氧化性又有还原性 )既有氧化性又有还原性 |
C.NH4HCO3溶液与过量的NaOH溶液微热反应:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.铜片溶于稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
下表中对离子方程式书写的评价错误的是()
| 选项 |
化学反应与离子方程式 |
评价 |
| A |
将铜屑加入含Fe3+的溶液中:2Fe3+ +Cu=2Fe2++Cu2+ |
正确 |
| B |
Na2O2与H2O反应:Na2O2+ H2O=2Na++2OH-+O2↑ |
错误,氧元素不守恒 |
| C |
NaOH溶液与氧化铝反应:Al2O3+ 2OH-=2AlO2-+H2O |
错误,产物应该是Al(OH)3 |
| D |
向Fe(OH)2中加入足量稀硝酸: Fe(OH)2+2H+=Fe2++2H2O |
错误,HNO3能氧化Fe2+ |
下列离子方程式书写正确的是()
| A.氢氧化镁与稀盐酸反应:H++OH-=H2O |
| B.向AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
能正确表示下列反应的离子方程式是 ()
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |