“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是 ( )
| A.2Na + 2H2O=2NaOH + H2↑是酸碱反应 |
B.ClO-+ H2O HClO + OH-是酸碱反应 HClO + OH-是酸碱反应 |
| C.碱性强弱顺序:ClO—>OH—>CHCOO— |
| D.HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是 
| A.原子半径:丙<丁<戊 |
| B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 |
| D.最外层电子数:甲>乙 |
下表是元素周期表的一部分,有关说法正确的是 
| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.六种元素中,c元素单质的化学性质最活泼 |
| D.c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
一定温度下,可逆反应N2+3H2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
| A.N2、H2、NH3浓度相等 |
| B.N2,H2,NH3分子数之比为1:3:2 |
| C.单位时间内生成nmolN2同时生成2nmolNH3 |
| D.单位时间内生成nmolN2同时生成3nmolH2 |
下列化学用语书写正确的是
A.氯原子的结构示意图: |
| B.作为相对原子质量测定标准的碳核素:614 C |
C.氯化镁的电子式: |
D.用电子式表示氯化氢分子的形成过程: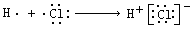 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.放热反应的反应物的总能量之和小于生成物的总能量之和 |
| C.同一化学反应,若反应条件不同,限度可能不同 |
| D.催化剂不但能改变反应速率,也能改变反应进行的限度 |