若20g密度为dg/cm3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是
A. mol/L mol/L |
B. mol/L mol/L |
| C.2.5d mol/L | D.1.25d mol/L |
1999年,在欧洲一些国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为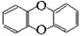 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )
| A.15种 | B.11种 | C.10种 | D.5种 |
含有一个三键的炔烃,氢化后的产物结构简式为: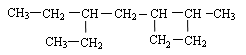
此炔烃可能有的结构简式为()
| A.1种 | B.2种 | C.3种 | D.4种 |
下列最简式中,没有相对分子质量也可以确定分子式的是()
①CH3②C2H5③C2H6O④CH2
| A.①②③④ | B.①②③ | C.①②④ | D.②③ |
下列各组中的反应,属于同一反应类型的是( )
| A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 |
| C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 |
| D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
NA为阿伏加德罗常数,下列说法正确的是()
| A.标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B.28g乙烯所含共用电子对数目为4NA |
| C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |