某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是 ( )
| A.2a+2 | B.2a+10 | C.a+2 | D.2a |
某主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有同分异构体 ( )
| A.2种 | B.3种 | C.4种 | D.5种 |
丙酸、甲酸乙酯和乙酸甲酯三种有机物共同具有的性质是 ( )
| A.都能发生加成反应 | B.都能发生水解反应 |
| C.都能跟稀H2SO4反应 | D.都能跟NaOH溶液反应 |
下列各组混合物中,用分液漏斗不能分离的是()
| A.甲苯和水 | B.乙酸乙酯和水 |
| C.丙三醇和水 | D.溴苯和水 |
区别甲烷、乙烯、乙炔最简单的方法是 ( )
| A.分别通入溴水 | B.分别通入酸性KMnO4溶液 |
| C.分别在空气中燃烧 | D.分别通入装有碱石灰的干燥管 |
以石墨电极电解200 mL CuSO4溶液,电解过程中产生气体体积V(g)(标准状况)与电子转移物质的量n(e-)的关系如下图所示,n(e-)=0.8 mol时停止电解。下列说法中正确的是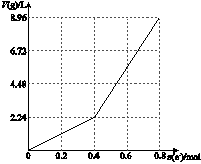
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.当n(e-)=0.6 mol时,V(H2)∶V(O2)=2∶3 |
| C.电解后所得溶液中c(H+)=2 mol/L |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |