化学反应N2+3H2  2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是
反应过程 ( )
A.N2(g)+3H2(g) 2NH3(l);ΔH=2(a-b-c) kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g);ΔH=2(b-a) kJ·mol-1 |
C.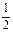 N2(g)+ N2(g)+ 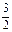 H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1 H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1 |
D.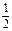 N2(g)+ N2(g)+ 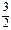 H2(g) NH3(g);ΔH=(a+b) kJ·mol-1 H2(g) NH3(g);ΔH=(a+b) kJ·mol-1 |
长式 周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A.第14列中元素中未成对电子数是同周期元素中最多的
B.只有第二列的元素原子最外层电子排布为ns2
C .第四周期第8列元素是铁元素
.第四周期第8列元素是铁元素
D.第15列元素原子的价电子排布为ns2 np5
常温下三氯化氮(NCl3)是一种淡黄色液体。以下关于NCl3的说法中,正确的是
| A.分子中 N-Cl键是非极性键 | B.分子中不存在孤对电子 |
| C.三氯化氮分子结构呈三角锥形 | D.因N-Cl 键键能大,它的沸点高 |
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
| A.硫化氢的沸点和水的沸点 |
| B.N的第一电离能和O的第一电离能 |
| C.Si—Si键的键能和C—C键的键能 |
| D.甲烷分子中C—H键的极性和氨分子中N—H键的极性 |
下列关于氨气和甲烷的说法不正确的是
| A.两种分子的VSEPR模型相同 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,而甲烷分子中没有孤对电子,两分子的立体构型不同 |
| D.氨气分子和甲烷分子都是含有极性键的非极性分子 |
2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
| A.Ds原子在周期表中位于第7周期第ⅦB族 | B.Ds是过渡元素 |
| C.Ds原子的核外电子数为110 | D.Ds为金属元素 |