短周期元素X、Y、z、W的原子序数依次增大,x原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个,Z的氧化物可做光纤电缆材料,W与X属于同一主族。下列叙述正确的是( )
| A.元素W的氢化物的热稳定性比X弱,因为X的氢化物分子间存在氢键 |
| B.四种元素形成的最高价氧化物对应水化物的酸性最强的是W |
| C.他合物YX、ZX2、WX3中化学键类型相同 |
| D.原子半径的大小顺序:r(Y)>r(Z)>r(X)>r(W) |
下列叙述中正确的是
| A.液溴应保存于带磨口玻漓塞的广口试剂瓶中,并加水“水封”以减少其易挥发 |
| B.向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
| C.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无 |
| D.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥 |
在水溶液中能大最共存的一组离子是
| A.Fe2+Al3+ ClO- Cl— | B.K+ Cu2+OH- NO3— |
| C.Na+ Ba2+ Cl—NO3— | D.Mg2+ H+SO42—SiO32— |
用如图装置进行实验,将液体A逐滴加人到固体B中.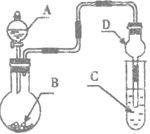
下列叙述正确的是
| A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中熔液最终呈红色 |
| B.实验仪器D可以起到防止溶液倒吸的作用 |
| C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 |
| D.若A为浓H2SO4.B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
1.92g铜投人一定盆的浓HNO3中、铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气休的容器倒扣在水中.通人标准状况下一定体积的.恰好使气体完全被水吸收生成硝酸。则通人O2的体积是
| A.504mL | B.336mL | C.224mL | D.168mL |
下列关干氧化物的各项叙述正确的是
①酸性氧化物不一定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物肯定是喊性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸性氧化物,与水反应生成碱的氧化物不一定是碱住氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
| A.①③⑥ | B.①②⑤⑦ | C.③④⑤ | D.①②⑤ |