将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4 + 10OH-— 8e- = CO32- + 7H2O;通入氧气的另一极,其电极反应式是2O2 + 4H2O +8e- = 8OH-,下列叙述正确的是
| A.通入甲烷的电极为正极 | B.燃料电池工作时,溶液中的阴离子向正极移动 |
| C.负极发生还原反应 | D.该电池使用一段时间后应补充氢氧化钾 |
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:()
| A.该溶液的pH="4" | B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 | |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是:()
| A.该溶液中存在着SO2分子 | B.该溶液中H+浓度是SO2- 3浓度的2倍 |
| C.向该溶液中加入足量的酸都能放出SO2气体 | |
| D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液 |
25 ℃时,下列各溶液中关系的叙述中,正确的是:()
| A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+) + c(H+)=c(OH-) + c(CH3COO-) |
| B.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2∶1 |
| C.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-) =" 0.1" mol/L,则BA(盐)溶液pH<7 |
| D.4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3④NaOH中c(Na+)的大小顺序 |
是①>②>③>④
图中a曲线表示一定条件下可逆反应:X(g)+Y(g) 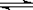 2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是:()
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是:()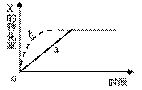
| A.增大体积 | B.增大Y的浓度 |
| C.降低温度 | D.缩小体积 |
反应2C + O2=2CO 的能量变化如右图所示。下列说法正确的是:()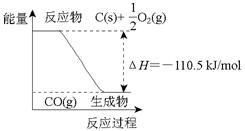
| A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| B.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
| C.该反应的热化学方程式是2C(s) + O2(g)=2CO(g)ΔH=-221 kJ |
| D.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |