(1)下图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀。
①写出B→C的化学方程式
②写出B→A的化学方程式
③C→F的离子方程式
④E→D的离子方程式
⑤上图中共发生了8个反应(每根箭头一个反应),其中有 个是氧化还原反应;从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强
(2)把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:
①由此可以推断:A为 ;C为 和
②写出D加入F生成E和G的离子方程式
③C通入澄清石灰水时,若气体通过量则白色沉淀又会溶解,写出白色沉淀溶解的化学方程式
(14分) 三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
Ⅰ.在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是。
A.反应后溶液中含有 |
B.反应后溶液中C( )增大 )增大 |
| C.实验过程中有化合反应发生 |
D.实验过程中 的电离程度不可能发生变化 的电离程度不可能发生变化 |
Ⅱ.有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按如表所示的量和反应条件在三颈瓶中加入一定量 ,再注入95%的乙醇,并加热,观察现象。
,再注入95%的乙醇,并加热,观察现象。
| 实验 |
 |
95%乙醇量/mL |
加热方式 |
| 实验1 |
2 |
4 |
酒精灯 |
| 实验2 |
2 |
4 |
水浴70 |
实验结果如下:
| 实验 |
实验现象 |
||
| 三颈瓶 |
收集瓶 |
试管 |
|
| 实验1 |
酒精加入时,立刻产生白雾,当用酒精灯加热时,有气泡产生,并逐渐沸腾,生成黏稠状液体 |
有无色液体 |
溶液褪色 |
| 实验2 |
酒精加入时,立刻产生白雾,当用水浴加热时,不产生气泡,一段时间后,反应瓶内生成黏稠状液体 |
有无色液体 |
溶液不褪色 |

根据上述材料,完成下列填空。
(1)写出实验室用乙醇制乙烯的化学方程式:。
(2)上图装置中冷凝管的作用是,进水口为(填“a”或“b”),浓硫酸的作用是。
(3)实验1使溴的四氯化碳溶液褪色的物质是。
(4)实验2中,水浴加热所需仪器有(加热、夹持仪器,石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式:。
(6)根据实验1、2可以推断:
①以 作为催化剂获得乙烯的反应条件是。
作为催化剂获得乙烯的反应条件是。
② 与95%乙醇在水浴70℃加热条件下可以发生的有机反应的类型是反应。
与95%乙醇在水浴70℃加热条件下可以发生的有机反应的类型是反应。
(14分,每空2分)乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是。
(3)进一步实验还可探索对出现银镜快慢的影响。
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为。过滤需要用到的玻璃仪器有(填编号)。
(5)操作④应在(填实验室设备名称)中进行。
(6)要洗去试管壁上的银镜,采用的试剂是(填名称)。
B.[实验化学]
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备在三颈圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。实验需要的药品:浓硫酸、冰醋酸和正丁醇。
(1)有同学拟通过核磁共振氢谱鉴定所得产物中是否含有正丁醇,正丁醇的氢谱线中的几个峰的面积之比是________。
(2)反应前三颈圆底烧瓶中先加人适量沸石,然后依次加入________。
(3)分水器的作用________。
Ⅱ.乙酸正丁酯粗产品的精制。
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用________洗涤有机层,用分液法分离上述有机层和水层,分液完成后,取出有机层的操作是________。
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品。
Ⅲ.计算产率
如果实验中加入了18.5 mL正丁醇、15.4 mL冰醋酸和2 mL浓硫酸,实验后制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为________。
(15分)硫化碱法是工业上制备硫代硫酸钠晶体(Na2S2O3·5H2O)的方法之一,流程如下:
已知:Na2S2O3在空气中强热会被氧化,Na2S2O3·5H2O在35 ℃以上的干燥空气中易失去结晶水。
(1)甲研究小组设计如下吸硫装置: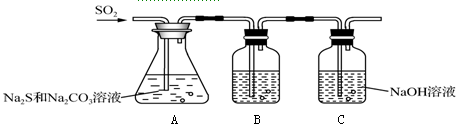
①写出A瓶中生成Na2S2O3的化学方程式________________________。
②装置B的作用是检验装置A中SO2的吸收效果,B中试剂可以是________,表明SO2未完全被吸收的实验现象是。
③为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可采取的合理措施是。(写出一条即可)
(2)从滤液中获得较多Na2S2O3·5H2O晶体的实验操作依次为:蒸发浓缩,冷却结晶,过滤,______________,______________。
(3)乙研究小组将二氧化硫气体和氯气同时通入足量氢氧化钠溶液中,小组成员认为吸收液中肯定存在Cl-、OH-和SO42-,可能存在SO32-或ClO-。为探究该吸收液中是否存在ClO-,进行了实验研究。请你帮助他们设计实验方案。(限选实验试剂:3 mol·L-1 H2SO4溶液、1 mol·L-1 NaOH溶液、溴水、淀粉KI溶液)。
下图为实验室制取氨的实验装置。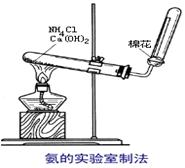
(1)写出A中所发生反应的化学方程式______________________________________________。
(2)该装置还可以制备哪种气体________。
(3)在收集氨时试管口棉花团的作用是。
(4)收集氨气应使用__________法,要得到干燥的氨气可选用__________作干燥剂.