B.[实验化学]
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备在三颈圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。实验需要的药品:浓硫酸、冰醋酸和正丁醇。
(1)有同学拟通过核磁共振氢谱鉴定所得产物中是否含有正丁醇,正丁醇的氢谱线中的几个峰的面积之比是________。
(2)反应前三颈圆底烧瓶中先加人适量沸石,然后依次加入________。
(3)分水器的作用________。
Ⅱ.乙酸正丁酯粗产品的精制。
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用________洗涤有机层,用分液法分离上述有机层和水层,分液完成后,取出有机层的操作是________。
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品。
Ⅲ.计算产率
如果实验中加入了18.5 mL正丁醇、15.4 mL冰醋酸和2 mL浓硫酸,实验后制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为________。
如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3+Cl2→N2+HCl并产生红光和白烟。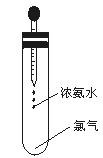
请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是。
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管.在室温时,进入试管内的水约占试管容积的。
(3)反应中生成的白烟是。
(4)用写出试管中反应的化学方程式。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。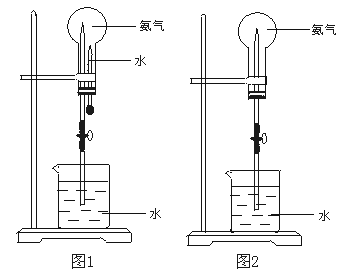
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法,要得到干燥的氨气可选用作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是,该实验的原理是。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
金币、银币、铜币等货币在我国历史上曾发挥过重要的作用。在一位收藏家的家中,陈列了很多金属货币。
(1)其中有些货币表面是黑色,且有少量的绿色锈状物,则这肯定是币,黑色物质是,形成这种物质的化学方程式为,绿色物质是,形成这种物质的化学方程式为。要除去这些物质应选用,发生反应的离子方程式为,充分反应后,这枚金属币的真面目为色。
(2)其中一枚是闪闪发光的黄色金属币,它肯定是币,表面一直未被氧化的原因是。
(3)若将金币、银币、铜币分别放到稀硝酸中浸泡,能溶解的是,不溶解的是,写出溶解时的化学方程式,若想溶解不能被硝酸溶解的钱币,则选用。
某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为:
①;②Al2O3+Na2CO3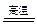 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(提示:NaAlO2易溶于水并转化为Na[Al (OH)4])
(2)最后得到的沉淀物是,生成沉淀的离子方程式为。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用坩埚。