水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
利用下图装置验证同主族元素非金属性的变化规律。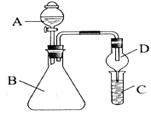
(1)若要证明非金属性:C1>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C溶液中的现象是_________,即可证明。可用_________溶液吸收尾气。
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是__________,即可证明。但有的同学认为盐酸具有挥发性,应用_________溶液除去。
Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
______________ |
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________________ |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
_______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________________。
某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为。
【提出假设】假设1:氧化剂只有Fe3+假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol•L-1的Fe(NO3)3溶液、0.2mol•L-1的KI溶液、0.01mol•L-1的KMnO4酸性溶液、0.01mol•L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 |
预期现象和结论 |
| ①取5ml0.2mol•L-1的Fe(NO3)3溶液和5ml0.2mol•L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 |
|
| ② ③ |
若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
【思考与交流】(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,则上述实验中步骤②和③的预期现象分别是什么?。
现有一试管NO2,某同学设计如下表实验,以尽可能多地使NO2被水吸收。
⑴请完成下表:
| 实验步骤 |
实验现象 |
解释(用化学方程式表示) |
|
| ① |
将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管。 |
试管内气体由 色逐渐变为无色,液面上升至试管高度的 (离管口)处。 |
|
| ② |
|||
| ③ |
重复步骤②的操作数次,直至液体充满整个试管。 |
试管内充满无色液体。 |
总反应方程式: |
⑵在下面方框中画出此实验的装置简图。
[化学—选修2:化学与技术]
最近科学家提出一种“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为甲醇。其技术流程如下:
(1)吸收池中饱和碳酸钾溶液的作用是;
(2)分解池中发生反应化学方程式为;
(3)上述流程中能体现循环利用的物质有;
(4)合成塔中生成甲醇的反应,其原子利用率理论上(能、否)达到100%。若合成塔中有2.2 kgCO2与足量H2恰好完全反应,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(5)如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为(填“可行”或“不可行”),理由是。
(6)上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300oC的温度,其原因是。