某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为:
① ;②Al2O3+Na2CO3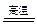 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(提示:NaAlO2易溶于水并转化为Na[Al (OH)4])
(2)最后得到的沉淀物是 ,生成沉淀的离子方程式为 。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用 坩埚。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”中得到一些认识,其实验小组设计了如图所示装置。试回答下列问题: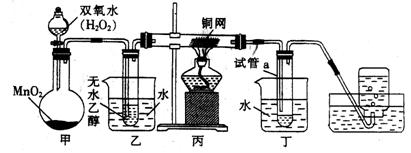
①甲中发生反应的化学方程式为。
②实验过程中铜网出现红色和黑色交替现象,请写出相应的化学方程式,从该实验现象中可以认识到实验过程中的催化剂(填“参加”或“不参加”)化学反应。当装置丙中反应进行一段时间后,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是(填“吸热”或“放热”)反应。
③乙、丁两个水浴装置的作用不同,乙中的作用是。
④反应进行一段时间后,试管a中能收集到的液体物质中可能含有。
(Ⅰ)已知常温下苯酚微溶于水,溶解 度为8.2g/100g水,其饱和溶液的物质的量浓度约为0.8mol/L。为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计了如下实验方案:
度为8.2g/100g水,其饱和溶液的物质的量浓度约为0.8mol/L。为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计了如下实验方案:
甲:向两只试管中,分别注入0.8mol/L的 乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙:在两只试管中,分别放入1 g乙醇和苯酚晶体,各注入3mL蒸馏水,振荡,得到乙醇溶液和苯酚浊液,再向两试管中逐滴加入5mol/L的NaOH溶液,观察其中的变化。
(1)苯酚与氢氧化钠溶液反应的离子方程式为,
对于甲、乙两个实验方案,他们能否达到实验目的?理由各是什么?
___________________________________________________________。
(Ⅱ)在分析甲、乙两同学实验方案的基础上,丙同学进行了下列对比实验:
在两只试管中,分别放入2 g无水乙醇和苯酚晶体,用约60℃的水浴加热,待苯酚熔成液态后,再向两试管中各放入一小块金属钠。在乙醇中,钠块能与乙醇反应产生气体,约3min后钠块消失,溶液保持澄清;在苯酚中,钠块表面有少量气泡, 约
约 2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
(2)丙同学的实验表明,苯酚熔融液与钠的反应速率不如无水乙醇的快,其主要原因是____________________________________,因此苯酚熔融液和无水乙醇与钠反应的有关事实_________(填“能”或“不能”)作为判断分子里羟基上氢原子哪个更活泼的依据。
(3)请你设计一个探究苯酚和 乙醇分子中羟基上氢原子活泼性的实验方案(可供选择的药品和仪器:乙醇、苯酚、蒸馏水、苯、钠、精确测
乙醇分子中羟基上氢原子活泼性的实验方案(可供选择的药品和仪器:乙醇、苯酚、蒸馏水、苯、钠、精确测 定溶液pH的仪器—pH计)
定溶液pH的仪器—pH计)
某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并 进行了以下一系
进行了以下一系 列实验,实验结果记录如下:
列实验,实验结果记录如下:
(1)实验①、⑤中Al电极的作用是否相同(填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。
(3)实验②中电流计指针偏向电极(填“Al”或“Cu”),Cu电极反应式为;
(4)实验④中铝为极(填“正”或“负”),其电极反应式为。
硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 |
温度] |
Na2S2O3溶液 |
H2SO4 |
加入H2O的体积 |
出现沉淀所需时间 |
||
| 体积 |
浓度 |
体积 |
浓度 |
||||
| Ⅰ |
0℃ |
5mL |
0.1mol·L-1 |
10mL |
0.1mol·L-1 |
5mL |
8s |
| Ⅱ |
0℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
12s |
| Ⅲ |
30℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
4s |
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知 。
实验室利用如图装置进行中和热的测定,请回答下列问题: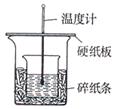
(1)在操作正确的前提下,提高中和热测定准确性的关键是
(2)做1次完整的中和热测定实验,温度计需使用次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
(3)请为本实验设计数据记录表格: