工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)如图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(g) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气________m3(标准状况)。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。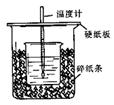
通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
某学生为了验证氢气还原氧化铜的产物,设计了下图所示的实验装置。
 ⑴写出编号仪器的名称:②
⑴写出编号仪器的名称:②
⑵浓H2SO4的作用是。
⑶本实验需要加热的装置为(填字母编号)。
⑷写出装置C、D中可观察到的现象:C ,D。
⑸ D中反应每生成1个水分子,转移的电子数为个。
按右图所示操作,充分反应后:
⑴ I中铁丝上观察到的现象 是
是 ;
;
反应的化学方程式为;
⑵ II中发生反应的化学方程式为 ;
;
⑶结合I、II实验现象可知,Fe、Cu、Ag的还原性顺序为。
(12分)由几种盐溶于水中形成的一瓶澄清的溶液,其中可能含有NH4+、Na+、Mg2+、Ba 2+、Al3+、Fe3+、C
2+、Al3+、Fe3+、C u2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
u2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,pH试纸呈红色。排除离子的存在。
(2)取出部分溶液,加入少量CCl4及几滴新制氯水,经振荡CCl4层呈紫红色。排除
离子存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除 离子的存在。
离子的存在。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。证明
离子存在,又排除离子存在。
(5)根据上述实验事实能否确定NH4+是否存在,若能,请简述理由,若不能,请简述检验它的方法 。
(6)原溶液一定存在的离子有,不能确定的离子有 。
Ⅰ.甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 |
50 |
20 |
20 |
10 |
5 |
| 取用砝码情况 |
先↓后↑ |
↓ |
先↓后↑ |
↓ |
先↓后↑ |
烧杯的质量为g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置g砝码,将游码的位置移到g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ.乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移⑤洗涤⑥定容⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是
(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)第③步实验的操作是
(3)第⑥步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面