从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下: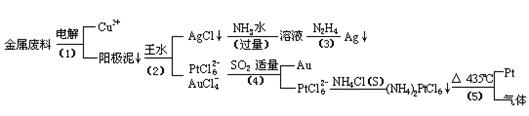
根据以上工艺回答下列问题:
(1) 电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
淡黄色固体X和气体A存在如下转化关系:
请回答下列问题:
(1)固体X的名称 ;A的化学式 。
(2)写出反应①③的化学方程式,并指出氧化剂。
反应① ,氧化剂是 。
反应③ ,氧化剂是  。
。
(3)写出②④反应的离子方程式:
反应② 。
反应④ 。
下列各组物质中括号中为杂质,请填写除去杂质所用的试剂及反应的离子方程式:
(1).NaHCO3溶液(Na2CO3),用__________试剂,离子方程式___________。
(2).CO2(HCl),用___________ 试剂,离子方程式。
现有下列物质:①液氨,②MgCl2晶体,③液态的醋酸,④汞,⑤BaCO3固体,
⑥矿泉水, ⑦酒精(C2H5OH), ⑧熔化的KOH, ⑨硫酸溶液, ⑩干冰;请用序号回答下列问题:
(1)以上物质中能导电的是___;(2)以上物质中属于电解质的是__________;
(3)以上物质中属于非电解质的是__________;(4)以上物质中属于强电解质的是____。
根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。
(1)氧化剂_________,还原剂__________,氧化产物,还原产物。
(2)氧化剂与氧化产物的质量比。
(3)当生成28gN2时,被氧化 的物质的质量是g。
的物质的质量是g。
有一包白色固体粉末,其中可能含有NaCl、BaCl2、Cu (NO3)2、Na2CO3中的。一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向 ①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④