甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
③定容的正确操作是 。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是 (填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处: 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系知下图所示。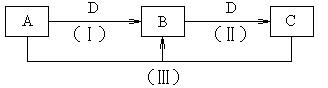
请回答下列问题:
⑴若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为,B的结构式为。
⑵若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则反应(Ⅱ)的化学方程式为。(写出一种即可)
⑶若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为。
⑷若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂。
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为。
②25℃时,0.1 mol·L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是溶液(填溶质的化学式)。
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为。
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)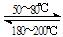 Ni(CO)4(g) 该反应的ΔH ▲0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g)ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式▲。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式▲。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与▲极(填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲(填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH=▲。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH=▲。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于▲mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-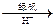 Cr3+
Cr3+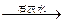 Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)▲ Kg(保留两位小数)。
(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: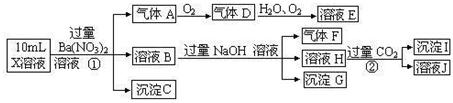
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是▲,不能确定是否含有的离子(M)是 ▲,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲。
▲。
(2)沉淀I的化学式为 ▲,气体F的电子式为▲。
(3)写出生成A的离子方程式:▲。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式▲。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为▲。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含▲。
(14分)已知:①NaNO2具有强氧化性
②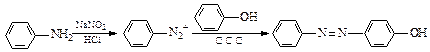
奥沙拉秦是一种抗菌药。其合成路线如下:
(1)写出下列反应的化学方程式:
水杨酸→A▲;A→B▲。
(2)写出D的结构简式▲。
(3)写出下列反应的反应类型:D→E▲,F→奥沙拉秦▲。
(4)整个合成路线看,设计B→C步骤的作用是▲。
(5)F的结构简式为 ▲。
▲。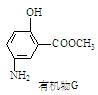
(6)有机物G(结构简式见上图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为▲。
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为▲。
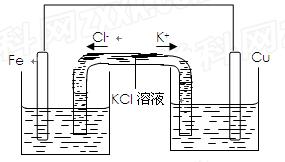
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。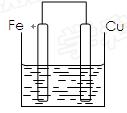
(1)铁片上的电极反应式为,铜片上的电极反应式为,铜片周围溶液会出现的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为mo1,该段时间内用硫酸铜表示的平均反应速率为。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入(填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是mo1/min。(以上均假设反应过程中溶液体积不变)。