用双线桥法表示出化合价的升降、电子转移数目,指出氧化反应和还原反应及氧化剂和还原剂.
(1)2KClO3 2KCl+3O2↑
2KCl+3O2↑
(2)4P+ O2  2P2O5
2P2O5
(14分)大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)===2NO(g);ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为CH4(g)+4NO(g)===CO2(g)+2N2(g)+2H2O(l),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是________。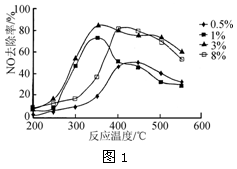

(3)臭氧也可用于烟气脱硝。
①O3氧化NO结合水洗可产生HNO3和O2,该反应的化学方程式为____。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为________。
(4)图3是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为________。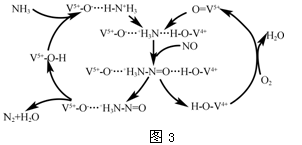
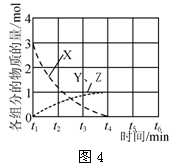
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式:____。
(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。
(15分)有机物H是一种新型大环芳酰胺的合成原料,可通过以下方法合成: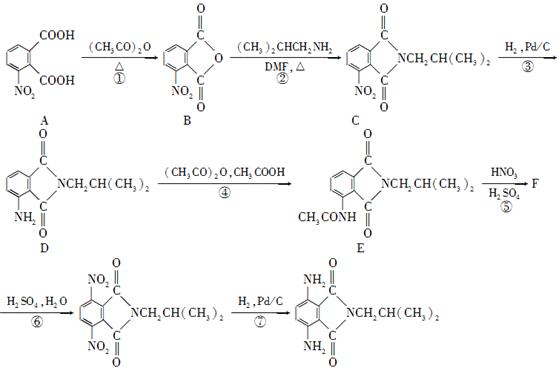
已知:①苯胺( )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化主要产物为间二硝基苯。
(1)写出A中含氧官能团的名称:________和________。
(2)写出F的结构简式:________。
(3)步骤④和步骤⑥的目的是____。
(4)写出一种符合下列条件的化合物C的同分异构体的结构简式:____。
①分子中含有2个苯环;
②能与FeCl3溶液发生显色反应;
⑧分子中有3种不同化学环境的氢原子。
(5)对苯二胺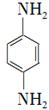 )是一种重要的染料中间体。根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是一种重要的染料中间体。根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
(12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90℃而不在室温下进行的原因是____。
(2)“酸溶”时,Al2O3发生反应的离子方程式为____。
(3)“氧化”时,发生反应的离子方程式为____。
(4)“废渣”成分为________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是____。
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g)△H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其发生可逆反应的方程式为。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,请写出该电极反应的方程式为。