(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。
如图是一个化学过程的示意图。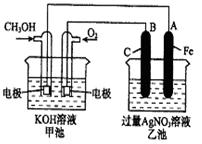
已知甲池的总反应式为:2CH3OH+3O2+4KOH
(1)请回答图中甲、乙两池的名称。
甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。由丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g) △H2=" +32.4" kJ·mol-1
(1) 相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷,电解质是熔融碳酸盐。电池正极的电极反应式为;放电时,CO32-移向电池的(填“正”,或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的pH=5.6,c(H2CO3)=l.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+ H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+ H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
已知一个碳原子上连有两个羟基时,其结构极不稳定,易发生下列变化,生成较稳定物质如:
A—F是六种有机化合物,它们之间的关系如下图,请根据要求回答:
(1)在一定条件下,经反应①后,生成C和D,C的分子式为,反应①的类型为。
(2)反应③的化学方程式为.
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有种结构,写出其中一种同分异构体的结构简式。
为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-="===" CO2 + 6H+
则正极发生的反应是;放电时,H+移向电池的(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+ 的平衡常数K=。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-) (填“>”、“=”或“<”),原因是(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
(16分) 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵[(NH4)2S2O8]和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)①反应I前需在FeSO4溶液中加入,以除去溶液中的Fe3+;
②反应I需控制反应温度低于35℃,其目的是。
(2) ①反应II所得的副产品是;试写出该副产品的一种用途为。
②检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
(3)煅烧FeCO3生成产品I的化学反应方程式为________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有。
(4)反应III常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为:。