A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示: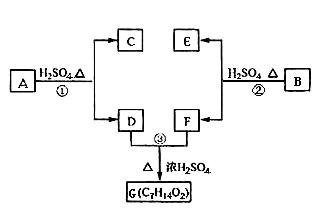
(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C的一溴代物只有两种,则C的结构简式为 。
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 ,D具有的官能团是 。
(3)反应①的化学方程式是
(4)芳香化合物B是与A具有相同官能团的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是 。
(5)E可能的结构简式是 。
研究NOx(氮的氧化物)SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)下图是 反应过程中能量示意图。
反应过程中能量示意图。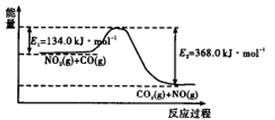
该反应的焓变
(2)一定条件下,通过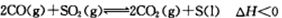 可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
①求以v(CO2)表示的反应速率为。
②该反应的平衡常数的表达式为:K=。
③若想加快正反应速率的同时提高SO2的转化率,可以采用的方法是。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
若用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为。
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是。
(2)比较元素B和C的第一电离能:BC(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为,盐Y的晶体类型是。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量:
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式。
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA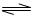 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。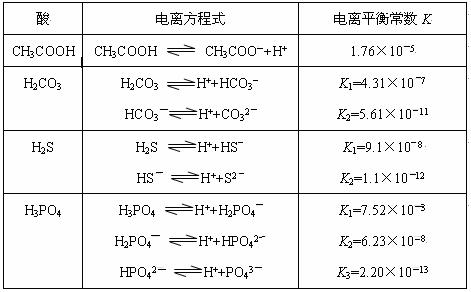
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=;P和Cl2一步反应生成1mol PCl5的△H4△H3 (填“大于”、“小于”或“等于”),原因是。
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,
⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是;
(4)以上物质中属于弱电解质的是;