X、Y、Z三种短周期元素,其单质在常温下都是无色气体,它们的原子序数之和为16。在适当条件下三种单质直接化合,可发生如右图所示变化。已知一个B分子中含有Z元素的原子个数比 C分子中的Z元素的原子个数少一个。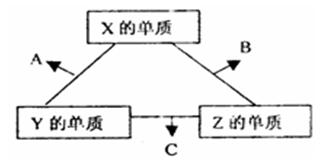
请回答下列问题:
(1)X、Z两元素也可按1:1组合成另一种物质D,D 的电子式为 ,A与C在一定条件下可生成无污染的物质,请写出该反应的化学方程式
(2)X的单质与Z的单质可制成新型的化学电 源(KOH溶液作
源(KOH溶液作 电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则:正极通入的物质名称是 ;负极电极反应式为 。
电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则:正极通入的物质名称是 ;负极电极反应式为 。
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”或“等于”)其原因是(用离子方程式表示): 。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温,恒压条件下反应。下列说法中,正确的是 (填写下列各项的序号)。
a.达到化学平衡后,再升高温度,C的体积分数增大
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.反应过程,Y的单质体积分数始终为50%
d.达到化学平衡的过程中,混合气体的密度增大
e.达到化学平衡时,正反应速率与逆反应速率相等
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生反应(填氧化或还原);电子从
经外电路到(填锌或铜),溶液中H+ 向移动(填正极或负极),放电一段时间后,正极区pH值(填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是,(填氢化物化学式),原因是;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水):。
按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为______________。
以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是(填序号),写出反应⑥的化学方程式______。
X、Y、Z三种短周期元素,原子序数依次增大,X的最外层电子数为次外层电子数的2倍,Y原子核外共有8个电子,Z是它所属周期中金属性最强的元素,可以和Y形成化合物Z2Y和Z2Y2。则:
(1)X的元素符号是,Y的元素名称是,Z的离子结构示意图为;
(2)Y元素在周期表第周期族
(3)化合物Z2Y的电子式为。
(4)Z2Y2和XY2反应的化学方程式是: