有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。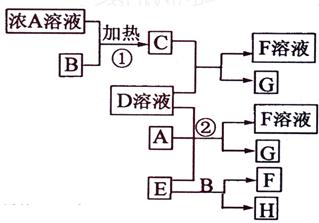
请 回答下列问题:
回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
Ⅰ.甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧热的热化学方程式为。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g)△H2=
O2(g)= CO2(g)+2H2(g)△H2=
已知H2(g)+ O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=。
(3)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)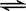 CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线。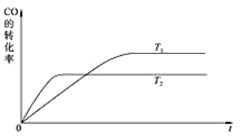
①该反应的焓变ΔH______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
Ⅱ.元素铬及其化合物工业用途广泛。但含+6价铬的污水会损坏环境。电镀厂产生的镀铜废水中含有一定量的Cr2O72-,处理该废水常用还原沉淀法。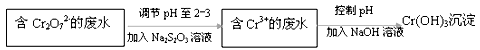
(1)下列溶液中可代替上述流程中Na2S2O3溶液的是(填选项序号)
| A.FeSO4溶液 | B.浓H2SO4 | C.酸性KMnO4 | D.Na2SO3溶液 |
(2)上述流程中,每消耗1mol Na2S2O3,转移0.8mol电子。则加入Na2S2O3溶液时发生反应的离子方程式为:。
(3)Cr(OH)3的化学性质与AlOH)3相似,在述流程中加入NaOH溶液时,需控制溶液的pH不能过高,用离子方程式表示其原因:。
甲醇是一种可再生能源,具有开发和应用的广阔前景,2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池方面取得了新的突破。甲醇燃料电池的工作原理如图甲装置所示。
(1)甲醇进入极(填“正”或“负”)。
(2)工作一段时间后,当0.2 mol甲醇完全反应生成CO2 时,有_____NA的电子转移。
(3)若甲装置中“负载”为图乙装置,则:A(Pt)电极的反应式为,乙装置中总反应化学方程式为。若乙装置溶液体积为500mL,且忽略电解过程中溶液体积的变化,A极的质量增加5.40g时,乙装置中所得溶液的H+的浓度为:。
(15分)甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。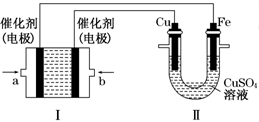
①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气________L(标准状况下)。
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:。
②若将(1)中的反应设计成原电池,写出电极反应式。
正极反应;负极反应___________________________。
(2)二甲醚(CH3OCH3)是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。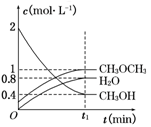
①该条件下反应平衡常数表达式K=_____。在T1℃时,反应的平衡常数为________;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正)v(逆)(填“>”、“<”或“=”)。
下表为元素周期表的—部分,请参照元素①一⑨在表中的位置,回答下列问题。
族 周期 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)第三周期中元素非金属性最强的元素的原子结构示意图是___________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是___________(填化学式)。
(3)用电子式表示③的氢化物:_________________________________。
(4)下列可以判断⑤和⑥金属性强弱的是______________________(填序号)。
a.单质的熔点⑤比⑥低
b.化合价⑤比⑥低
c.单质与水反应⑤比⑥剧烈
d.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化: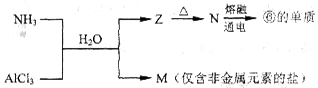
a.Z的化学式是___________。
b.N生成⑥的单质反应的化学方程式是_________________________________。