(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
②若将(1)中的反应设计成原电池,写出电极反应式。
正极反应 ;负极反应___________________________。
(2)二甲醚(CH3OCH3)是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。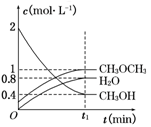
①该条件下反应平衡常数表达式K=_____。在T1℃时,反应的平衡常数为________;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)。
(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: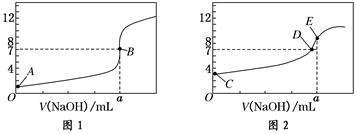
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。
钙、镁、铝等的化合物在生产生活中有着广泛的应用。甲、乙两研究小组分别对石灰乳吸收硝酸工业的尾气、碱式碳酸镁铝[MgaAlb(OH)c(CO3)d·xH2O]的有关问题进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得有广泛应用的Ca(NO2)2,其部分实验流程如下: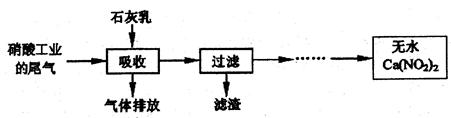
①大量氮氧化物排放到空气中,会破坏臭氧层,形成酸雨等,由氮氧化物形成的酸雨称为是_________(填“硫酸”或“硝酸”)型酸雨。过滤操作中,需要使用的玻璃仪器有烧杯、玻璃棒和_______________。
②上述流程中采用“气一液逆流接触”吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_________________;滤渣可循环使用,滤渣的主要成分是________。
(2)乙组查阅有关资料知道碱式碳酸镁铝受热容易分解,因此在生产生活中常用作塑料阻燃剂。
①MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为______________________。
②根据你的理解,你认为碱式碳酸铝镁具有阻燃作用的可能原因主要是由于其受热分解需吸收大量热量和_______________________________。
③为确定碱式碳酸铝镁的组成,进行如下实验:准确称取6.780 g样品与足量稀盐酸充分反应,生成CO2 1.120 L(已换算成标准状况下)。另取一定量样品在空气中加热,样品的固体残留率随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。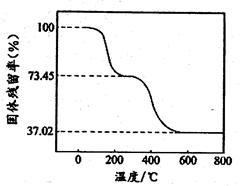
注意:固体残留率是指 。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。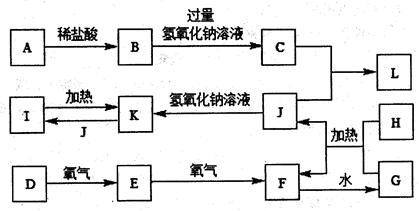
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:_________________________________________。
(4)写出A与稀盐酸反应的离子方程式:_____________________________________。
化学和材料开发制造、科学研究、生产生活等密切相关。
(1)第十八届江苏省运动会于2014年9月19日在徐州奥体中心开幕,奥体中心建筑采用了世界领先的钢结构技术,建筑材料中还使用了大量的铝合金、玻璃等。
①工业上铁的冶炼是在______中进行的,主要原料有铁矿石,焦炭、空气、______等。
②下列有关铝合金性能的叙述正确的是_________(填字母)。
a.密度大 b.强度小 c.耐腐蚀
③下列物质中,不是工业上制造玻璃的主要原料的是___________(填字母)。
a.水玻璃 b.二氧化硅 c.碳酸钠
(2)化工生产和科学研究中,经常需要配制一定物质的量浓度的溶液。
①在实验室,使用容量瓶来准确配制_______________、一定浓度的溶液。
②欲配制1.00 mol/L的氯化钠溶液100 mL,用不到的仪器是____________(填“烧杯”、“玻璃棒”或“分液漏斗”)。配制500 mL0.l mol/L氢氧化钠溶液需要氢氧化钠的质量是___________g。
③在溶液稀释前后,溶液的体积发生了变化,但溶液中____________的物质的量不变。配制一定物质的量浓度的Na2CO3溶液时,下列操作正确的是___________(填字母)。
a.将称好的固体在烧杯中溶解,所得溶液冷至室温再转移到容量瓶中
b.定容时,如果加水超过了刻度线,用胶头滴管直接吸出多余的部分
c.定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线
(3)物质的结构决定物质的性质,物质的性质关系到物质的用途。
①以电解__________为基础制备氯气等产品的工业称为氯碱工业。在实验室要将氯化钠溶液和氯化钾溶液区别开来,可以采用的方法是_________________。
②当分散剂是水或其他液体时,根据__________直径大小的不同,可以将分散系分浊液、胶体和溶液。在实验室区分胶体与溶液常用的一种物理方法为_____________。
③在生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为________________________________________________。
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。
它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。