现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。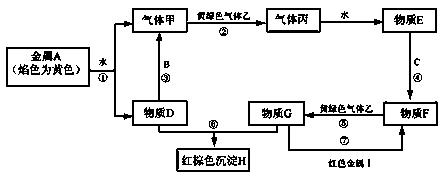
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的化学方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
实验室检验物质D中阳离子的方法是
“雾霾”已成为当今世界环境热点话题,为减少CO、SO2、NOx等气体的排放,某环境小组研究使用如下方式。
Ⅰ.使用清洁能,例如二甲醚( DME)。现由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g)ΔH1=—90.7KJ/mol
CH3OH(g)ΔH1=—90.7KJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH2=—23.5KJ/mol
CH3OCH3(g)+H2O(g)ΔH2=—23.5KJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g) ΔH3=—41.2KJ/mol
CO2(g)+H2(g) ΔH3=—41.2KJ/mol
回答下列问题:
(1)则反应3CO(g)+3H2(g)  CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
(2)将合成气以甲n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。
CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。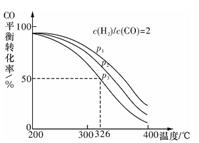
A.△H<O
B.P1< P2<p3
C.若在p3和316℃时,起始n(H2)/n( CO)= 3,则达到平衡时,CO的转化率小于50%
(3)如图为绿色“二甲醚燃料电池”的工作原理示意图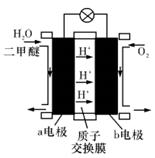
a电极的电极反应式为:
Ⅱ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数 (CO2)随时间t变化曲线如图。
(CO2)随时间t变化曲线如图。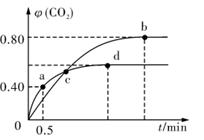
请回答:(1)从反应开始至a点时的反应速率为v(CO)。
(2)b点时化学平衡常数Kb=。
(3)下列说法不正确的是 (填字母序号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.增大d点的体系压强,CO的转化率不变
D.b点和d点的化学平衡常数:Kb<Kd
将6mol A和5 mol B混合放入4L密闭容器中,在一定条件下发生反应:
3A (g) +B(g)  2C(g) + xD(g),经5 min达到平衡,此时C的浓度为0.5 mol·L-1,测得D的平均反应速率为0.15 mol·L-1·min-1,则平衡时A的物质的量浓度为,B的平均反应速率为,x的值为。
2C(g) + xD(g),经5 min达到平衡,此时C的浓度为0.5 mol·L-1,测得D的平均反应速率为0.15 mol·L-1·min-1,则平衡时A的物质的量浓度为,B的平均反应速率为,x的值为。
请回答下列问题:
(1)NH4Cl溶液显性,原因是(用离子方程式表示),NH4Cl溶液中离子浓度由大到小的顺序为。
(2)常温下,0.10 mol/L的CH3COOH溶液中,c(H+)0.10 mol/L(填“>”、“<”、“=”)。
CH3COOH在水溶液中的电离方程式为
(3)将浓度均为0.10 mol/L的CH3COOH溶液和NaOH溶液混合后,若pH>7,则该溶液中c(CH3COO-)___c(Na+)。(填“>”、“<”、“=”)。
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:
。
已知1mol液态水汽化时需要吸收44 kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为kJ。
(2)有同学制作一氢氧燃烧电池,通入H2的一极为极。若以稀硫酸为电解质溶液时,其正极反应式为。
如图是以石墨为电极电解CuCl2溶液的装置示意图。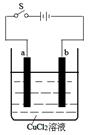
(1)电解过程中,a电极为极,该电极上发生的电极反应式为:。
(2)电解一段时间后,b电极上可观察到的现象是:。
(3)电解过程中能量转化的主要形式是。