学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。
(1)请你写出发酵粉中的主要钠盐的化学 式______________。
式______________。
(2)请你写出下列反应的化学方程式。(注意反应条件并配平)
工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙) 。
(3)`请你写出下列反应的离子方程式。
胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多 。
将铁加入硫酸铜溶液中炼铜(湿法炼铜) 。
聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为 ,其工业合成路线如下:
,其工业合成路线如下: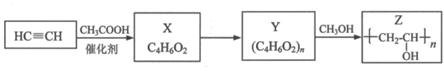
已知:下列反应中R,R',R"代表烃基
i. 
ii. 
回答下列问题:
(1)乙炔的空间构型是____________;
(2)X的结构简式是________________________;
(3)Y转化为Z的化学方程式是________________________;
(4)在一定条件下,也可用乙烯、氧气和乙酸制取X,该反应的化学方程式是_____________________;
(5)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。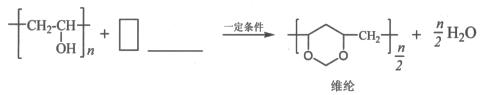
有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。
已知:有机物A的仪器分析如下:
①有机物A的质谱
②有机物A的红外光谱
③有机物A的核磁共振氢谱图上有2个吸收峰,峰面积之比是1:1。
回答下列问题:
(1)A的相对分子质量是____________;
(2)A含有官能团的名称是____________;
(3)A与氢氧化钠溶液在加热条件下反应的化学方程式是____________________________________;
(4)A有多种同分异构体,其中能与新制Cu(OH) 2共热,产生红色沉淀的有____________种,写出其中任意一种同分异构体的结构简式________________________。
甘蔗渣可综合利用,回答下列问题。
Ⅰ. 甘蔗渣可生成一种常见单糖A,A在乳酸菌的作用下生成有机物B,B经过缩聚反应生成可降解塑料,其结构简式为:
(1)A的分子式是____________;
(2)下列有关B的叙述正确的是____________(填序号);
A. B的分子式为C3H6O3 B. 1 mol B可与2 mol NaOH反应
C. 1 molB与足量的Na反应可生成1 molH2
(3)B在一定条件下可生成C,C能使溴的四氯化碳溶液褪色。B生成C的化学方程式是____________;
Ⅱ. 甘蔗渣还可生产一种重要的化工原料D,D的相对分子质量为90,1 mol D与足量NaHCO3反应放出标准状况下44.8 L CO2。
(4)D的官能团名称是____________;
(5)等物质的量的D与乙二醇在催化剂作用下可生成链状高分子化合物,其化学方程式是________________
有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。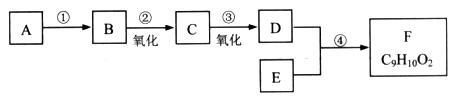
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。
下图是某烃A分子的球棍模型。回答下列问题: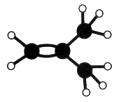
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
A. 氧化反应 B. 加成反应 C. 消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是________________________________。