聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为 ,其工业合成路线如下:
,其工业合成路线如下: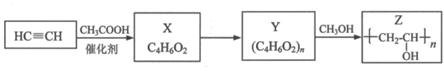
已知:下列反应中R,R',R"代表烃基
i. 
ii. 
回答下列问题:
(1)乙炔的空间构型是____________;
(2)X的结构简式是________________________;
(3)Y转化为Z的化学方程式是________________________;
(4)在一定条件下,也可用乙烯、氧气和乙酸制取X,该反应的化学方程式是_____________________;
(5)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。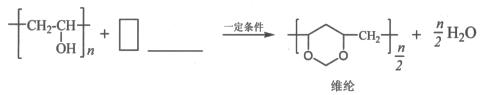
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)=。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①则该反应△H0,表中数据ad,bf(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是,原因是。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:。
| 电离能/(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:
[Mn(H2O)6]2+(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 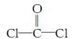 ,每个COCl2分子内含有个σ键,个π键,其中心原子采取杂化轨道方式。
,每个COCl2分子内含有个σ键,个π键,其中心原子采取杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是。
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)△H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g)△H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。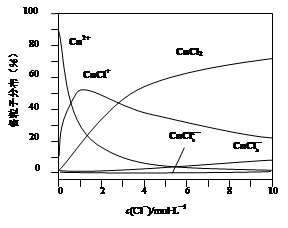
①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。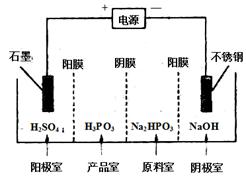
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
| a |
|||||||||||||||||
| b |
c |
d |
|||||||||||||||
| e |
f |
g |
|||||||||||||||
| h |
I |
(1)元素h的四价阳离子的外围电子排布式为。
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为。
1 mol 苯甲醛分子中含有σ键的数目为。
(4)元素d与e形成的化合物常用于制作材料,其原因是。
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为。
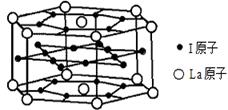
(6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为。