现有以下有机物:
①CH3CHO ②CH3CH2OH ③CH3COOH ④HCOOC2H5
(1)能与NaOH溶液反应的有_________________;
(2)能与银氨溶液反应的有____________________;
(3)既能发生消去反应,又能发生酯化反应的有___________________;
(4)能发生氧化反应的有(除燃烧以外)___________;
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。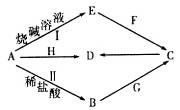
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。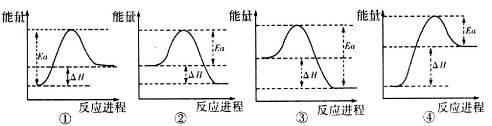
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。
下表为元素周期表的一部分,其中的编号代表对应的元素。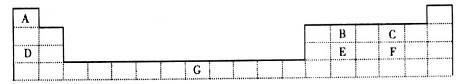
(1)写出E元素原子的结构示意图_________________________。
(2)D的单质在C的单质中燃烧所得产物中存在的化学键类型是________________。
(3)写出B单质与F的最高价氧化物对应水化物反应的化学方程式______________________________。
(4)一定条件下,用单质D还原CCl4可制备金刚石,反应结束冷却至室温,回收CCl4的实验操作名称是______________;选用一种常用试剂可除去粗产品中少量单质D,写出发生反应的化学方程式___________________________________________________。
(5)G的某种氯化物溶液呈浅绿色,向该溶液中加入NaOH溶液,充分反应,一段时间后有红褐色物质生成,请写出该过程中发生反应的化学方程式________________________。
某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、OH-离子中的一种或几种,现通过以下实验进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,
(3)向上述溶液中加入BaCl2溶液,无现象。
据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 ,依次写出(2)中加入氢氧化钠后的离子反应: , 。
(1)标况下5.6L的CO2质量为 g,其中含有 个分子,含有 个原子;
(2)质量均为m g的 HCl、NH3、CO2、O2四种气体,所含分子数目最少的是 ,体积最大的是 ,密度最小的是 (在相同温度和压强条件下);
(3)在 mL 0.2 mol/L NaOH溶液中含有1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g;从该CuSO4溶液中取出5mL液体,其中Cu2+ 的物质的量浓度为__________mol/L,将该5mL溶液加水稀释至20mL,Cu2+的物质的量浓度变为_________mol/L。
选择下列实验方法分离物质,将正确分离方法的序号填在横线上。
A 萃取 B 升华 C 结晶 D 分液 E 蒸馏 F 过滤
(1)分离饱和食盐水与沙子的混合物__________
(2)提取碘水中的碘单质________
(3)分离水和汽油的混合物________
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物________