已知有机物甲、乙、丙有如下信息:
| |
甲 |
乙 |
丙 |
| 所含元素 |
C、H |
C、H、F |
C、H、F |
| 所含电子数 |
26 |
|
|
| 结构特点 |
饱和有机物 |
|
|
据此推断:
(1)甲的分子式为 ,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有 种。
(2)乙是性能优良的环保产品,可代替某些破坏臭氧层的氟利昂产品用作制冷剂。其分子中C、H、F的原子个数之比为1∶2∶2,则乙的结构简式为 。下列关于乙的叙述中正确的是 。
A. 其分子构型为正四面体型 B. 它能与溴水发生反应而褪色
C. 1 mol乙最多能与1 mol F2发生取代反应 D. 它没有同分异构
(3)将甲、乙按物质的量之比1∶1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,但丙分子不存在同分异构体,则丙的分子式为 。
(1)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至钡离子恰好沉淀完全,请写出发生反应的离子方程式:。
(2)在以上溶液中,继续滴加NaHSO4溶液,请写出此步反应的离子方程式:。
某同学从一种未知的无色溶液中检验出有Ba2+、Ag+,同时溶液的酸性较强,他还准备继续检验溶液中是否含有Cu2+、Cl-、CO32-、K+、SO42-、NO3-等离子。显然,有些离子还必须检验,有些离子已不需检验。你认为还必须检验的离子有
。
下面所列物质中,属于强电解质的是(填序号,下同),属于弱电解质的是,属于非电解质的是。
①碘化钾 ②乙醇 ③醋酸 ④氨气 ⑤蔗糖 ⑥氢硫酸 ⑦硫酸氢钠 ⑧氯气 ⑨ 碳酸钡
图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上
一氯取代位置有三种。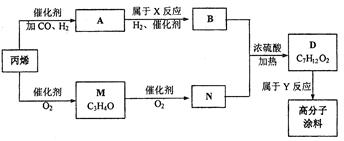
(1)试写出下列物质的结构简式:A M
(2)写出反应N+B D的化学方程式:
D的化学方程式:
(3)写出反应类型:x ,Y
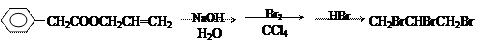
(1)写出以上有机物转化过程中各步反应的化学方程式
第一步:
第二步:
第三步:
(2)写出CH2BrCHBrCH2Br的所有同分异构体的结构简式