某学生设计氨催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成。可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO。可供选择的液体药品有:H2O2、浓盐酸、水。可供选择的仪器有: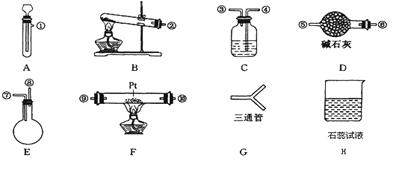
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置均允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应应在装置 中进行。
(2)制取NH3的装置最好选择 ,其化学反应方程式为 ;为快速制取O2的装置最好选择 ,其化学反应方程式为 。
(3)各仪器按气流方向连接的正确顺序为:
A、B→G→ → F → → → H。(按装置先后排列顺序补充完整)
(4)装置C的作用是 。
( 5 ) 如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中
氨气是否集满(简述操作、现象和结论)?
(6)装置H中溶液显红色,其原因是
(7)请据以上实验事实设计一个实验来检验一份白色药品是铵盐,写出其正确
的实验操作步骤
氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:



 (氯普鲁卡因盐酸盐)
(氯普鲁卡因盐酸盐)
请把相应反应名称填入下表中,供选择的反应名称如下:
氧化、还原、硝化、磺化、氯代、酸化、碱化、成盐、酯化、酯交换、水解
| 反应编号 |
① |
② |
③ |
④ |
⑥ |
| 反应名称 |
(6分)如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是_________ (指悬吊的金属圈)。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
(2)产生上述现象的原因是_________。
银及银合金材料是“神七”问天携带研究材料之一。银是日常生活中常见的金属,如银元、银手饰、银器等。
I.某研究性学习小组,设计实验探究某银元中银的质量分数(银元主要成分是银,含少量铜杂质)。取一块银元称质量为Wg,溶于足量的稀硝酸中,充分反应后,在溶液中滴加过量的盐酸,过滤、洗涤、烘干、称重得到固体质量为ag。
(1)根据上述数据,计算该银元中银的质量分数为 。
(2)下列情况使测定银元中银的质量分数偏高 。
A.烘干时,温度偏高B.加入盐酸不足
C.沉淀没有洗涤干净D.加入硝酸溶液浓度过大
II.原子利用率是衡量化学反应绿色化的重要依据之一,原子利用率= 。硝酸银是中学重要化学试剂,某同学利用瓶胆上银制取硝酸银:
。硝酸银是中学重要化学试剂,某同学利用瓶胆上银制取硝酸银:
方案1用14mol/L硝酸溶液溶解银制硝酸银;方案2用2mol/L硝酸溶液溶解银制硝酸银。
(3)写出化学方程式:方案1 。
(4)方案1原子利用率为 ;方案2原子利用率为 。
你认为符合绿色化学要求的方案是 ,理由是 。
(5)已知硝酸银固体受热易分解,硝酸银溶解度变化规律类似硝酸钾的溶解度变化规律。
从硝酸银溶液中分离硝酸银的方法是 。
①冷却热饱和硝酸银溶液,结晶;②蒸发溶剂,结晶。
除去硝酸银晶体表面杂质,适宜采用下列方法: 。
A.用蒸馏水洗涤B.用75%酒精洗涤
C.用饱和硝酸钠溶液洗涤D.用四氯化碳洗涤
除去硝酸银晶体表面的水份,下列措施合适的是 。
a.加热烘干b.吹气凉干c.用滤纸吸干
2008年10月14日长江商报报道:湖北监利钒污染致近千人患严重皮肤病。监利县有投产和在建的非法钒冶炼厂达9家,非法钒冶炼厂所造成的污染使得草木枯萎,饮水变咸,清河变浊,人畜奇怪病变,曾经的鱼米之乡正受到前所未有的污染威胁。钒和钒(V)的化合物在工业上有重要用途。如五氧化二钒是工业接触法制硫酸的催化剂。查阅资料知,利用钒矿石制五氧化二钒和钒的工艺流程图如下:
(1)钒(V)的原子序数为23,下列对钒在元素周期表中位置和元素类别判断正确的是。
A.它位于第五周期第ⅤB族 B.它位于第四周期第ⅤB族 C.它是过渡元素
D.它位于第五周期第ⅤA族 E.它位于第四周期第ⅤA族 F.它与铁位于同一周期
(2)工业上,接触法制硫酸在接触室里发生反应:2SO2+O2 2SO3,催化剂一般是V2O5,下列对五氧化二钒作用的描述正确的是。
2SO3,催化剂一般是V2O5,下列对五氧化二钒作用的描述正确的是。
A.能增大该反应所需要的能量 B.能提高二氧化硫的转化率
C.能改变该反应的反应热(△H) D.能同程度增大正、逆反应速率
E.能增加SO2和O2分子的能量
(3)写出下列化学方程式:
反应I:;反应III:;反应IV:。
(4)预测反应II发生的原因是;IV的反应类型是。
已知:①通常Br2与“C=C”双键起加成反应,但高温下Br2易取代与“C=C”双键直接相连的α-碳原子上的氢原子:
②与苯环直接相连的支链碳原子上的氢原子也易被溴取代: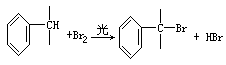
③卤代烃在一定条件下可以水解成醇:
卤代烃也可在一定条件下发生消去反应生成烯烃:
</PGN0069B.TXT/PGN>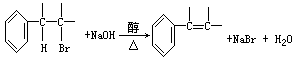
根据上述有关知识推断如何从正丙苯制取1-苯基丙三醇:C6H5—CHOH—CHOH—CH2OH,写出各步反应方程式(注明反应条件)。