由氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为( )
| A.1.6a g | B.(a —1.6) g | C.(a — 3.2) g | D.无法计算 |
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
| X |
|||
| Y |
Z |
W |
|
A.最高价氧化物对应水化物的酸性Y>Z>W
B.含Y元素的盐溶液一定显酸性
C.原子半径:rW>rZ>rY>rX
D.X与W的气态氢化物可相互反应生成离子化合物
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向鸡蛋白溶液中滴入HgCl2溶液 |
有白色沉淀 |
蛋白质发生盐析 |
| B |
向溶液X中滴加BaCl2溶液 |
有白色沉淀 |
X中一定含有SO42- |
| C |
AgCl饱和溶液中加入少量NaI溶液 |
产生黄色沉淀 |
Ksp(AgI)>Ksp(AgCl) |
| D |
向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 |
红色逐渐退去 |
Na2CO3溶液中存在水解平衡 |
常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解)。下列说法不正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(NH4+)+c(H+)+ c(Na+)=c(OH-)+2c(SO42-) |
| D.点d所示溶液中:c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1 |
在指定溶液中一定能大量共存的离子组是
| A.1.0mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.pH=1的溶液:NH4+、Al3+、SO42-、Br- |
| C.c(ClO-)=1.0mol·L-1的溶液:Na+、SO32-、S2-、Cl- |
| D.与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42- |
下图为香芹酮分子的结构,下列有关叙述正确的是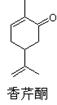
| A.香芹酮化学式为C9H12O |
| B.香芹酮可以发生加成反应、消去反应和氧化反应 |
| C.香芹酮能使酸性KMnO4溶液褪色 |
| D.香芹酮分子中有3种官能团 |