工业上用饱和电解食盐水来制取氯气。现取500mL 含NaCl为11.7g的饱和食盐水进行电解。
⑴在标准状况下制得Cl2多少升?
⑵所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
1L乙炔和气态烯烃混合物与11L O2混合后点燃,充分反应后,气体的体积为12L,求原1L混合气体中各成分及物质的量比(反应前后均为182℃、1.01×105Pa)。
丁烷催化裂化时,碳链按两种方式断裂生成两种烷烃和烯烃,若丁烷裂化率为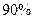 ,且裂化生成的两种烯烃的质量相等,求裂化后得到的相对分子质量最小的气体在混合气体中所占的体积分数。
,且裂化生成的两种烯烃的质量相等,求裂化后得到的相对分子质量最小的气体在混合气体中所占的体积分数。
将x mol O2,ymol CH4和z mol Na2O2放入密闭容器中,在150℃条件下用电火花引发,恰好完全反应后,容器内压强为0,通过计算确立x,y和z之间的关系式。
CH4和C2H4混合气体,其密度是同温同压下乙烷的 ,求混合气体中CH4的质量分数。
,求混合气体中CH4的质量分数。
一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g,则该混合气体是由什么组成的?