火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_________ _。
_。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),
分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间
后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,则
上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2
和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是__________(填
字母代号)。
| A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5 mol·L-1 |
| B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.该温度下,反应的平衡常数的值为3/16 |
E. 升高温度将使n(CH3OH)/n(CO2)减小
升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为_______。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为__________。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:__________;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)__________c(NO3-)+c(OH-)(填写“>”“=”或“<”)
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
(2)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,FeS、O2、H2SO4反应的方程式是;
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_______________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g。若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数[Mr (BaSO4) =233、Mr (Fe) =56]。(写出计算过程,结果保留4位有效数字)。
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
| 所加试剂 |
预期现象和结论 |
| 试管A中加足量①; 试管B中加1%品红溶液; 试管C中加②。 |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③则消毒液未变质; ④则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入(填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为mol·L-1(用含a、b、c、v的代数式表示)。
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: 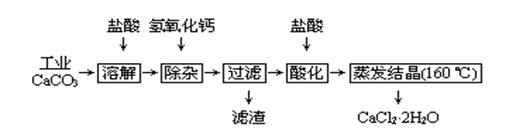
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
|
| 开始沉淀时的pH |
2.3 |
4.0 |
开始溶解:7.8 |
| 完全沉淀时的pH |
3.7 |
5.2 |
完全溶解:10.8 |
(1)CaCO3与盐酸反应的离子方程式。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
。
(3)过滤时需用的玻璃仪器有。滤渣主要成分的化学式。
(4)酸化时加盐酸的目的为:①,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃:。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。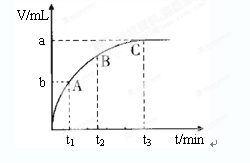
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式:。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是。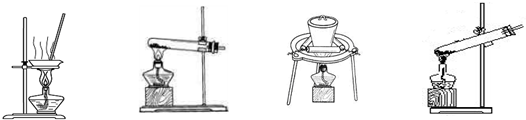
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 |
现象:溶液中产生大量白色沉淀; 结论:。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入, 振荡,观察 |
现象:; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象:; 结论:。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度:mg/L(Cl的相对原子质量:35.5)