将一定量的SO2和含0.7mol的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2 (g) + O2(g)  2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
(1)判断该反应达到平衡状态的标志是______________。
A.SO2和SO3浓度相等
B.SO2的百分含量保持不变
C.SO3的生成速率与SO2的消耗速率相等
D.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_____________。
A. 向装置内再充入N2 B. 向装置内再充入O2
C. 改变反应的催化剂 D. 升高温度
(3)求该反应达到平衡时SO2的转化率
(4)若将平衡混合气体的5 %通入过量的BaCl2溶液,生成沉淀多少克?
在25℃时,用石墨电极电解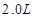 ,
,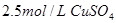 溶液,如有
溶液,如有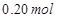 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:
(1)阴极发生反应,电极反应为。
(2)阳极发生反应,电极反应为。
(3)电解后得到的 的质量是,得到
的质量是,得到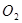 的体积(标准状况)是。
的体积(标准状况)是。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的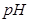 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。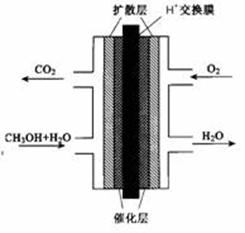
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+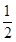 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+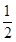 O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),正极发生的电极反应式为 。负极发生的电极反应式为 。
已知2A(g)+B(g)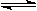 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
⑴能说明上述反应已经达到化学平衡状态的是(填写序号)
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
⑵若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为(用含Q1、Q2的代数式表示);
⑶500℃时,上述反应的化学平衡常数K=;
⑷已知:K(300℃)>K(350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A的转化率(填“增大”、“减小”或“不变”);
⑸某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)K(B)(填“>”、“<”或“=”)。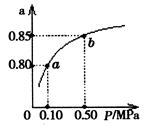
已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请填空:
(1)写出A、B、C、D对应的元素符号:A________、B________、C________、D________。
(2)写出工业生产中BD3与氧气反应的化学方程式:
________________________________________________________________________。
(3)你认为B、C、D元素形成的化合物之间________(填“能”或“不能”)发生下面的反应BC+BD3―→DBC2+D2C,得出上面结论的理由是__________________________ _。
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 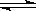 4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
Ⅱ. 若维持温度不变,在一个与Ⅰ反应前的起始体积相同,容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a________b(填“>”“<”“=”或“不能确定”)。
(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为。
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度:> > 。
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
(4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零