A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍。A、 E同主族,D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C____________ E_____________;
(2)A 、C能形成多种化合物,其中C2A4的结构式为______ (用元素符号回答,下同);
(3)化合物E2D2中存在的化学键类型为_______________________________;
(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反 应的离子方程式为____________;
应的离子方程式为____________;
(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为________________________。
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。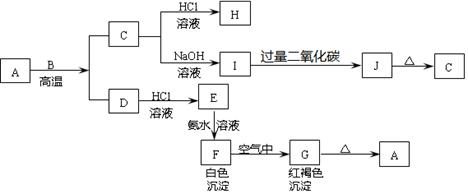
(1)写出下列物质的化学式:
A:E:J:G:
(2)按要求写方程式:
①A与B生成C和D的化学方程式:。
②F在空气中转化为G的化学方程式:。
③I转化为J的离子方程式:。
某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下: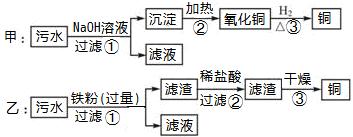
(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙________。
(2)在可制得铜的方案中,写出所有反应的离子方程式_______________________。
(1)在一定条件下,RO3n-和 氯气可发生如下反应:RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O;由以上反应可知在RO3n-中,元素R的化合价是。
氯气可发生如下反应:RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O;由以上反应可知在RO3n-中,元素R的化合价是。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应方程式如下:2KMnO4 + 16HCl(浓) =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O;当有0.10mol电子发生转移时,生成氯气的体积(标准状况),发生反应的高锰酸钾的质量为,被还原的氯化氢的物质的量。
下列做法合理的是_________(填序号)。
①用无色试剂瓶盛放新制氯水
②海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
③用托盘天平称量11.7 g氯化钠固体
④2010年云南遭遇百年一遇的全省性特大旱灾,缓解旱情的措施之一是可以用干冰或溴化银进行人工降雨
(13分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) 2NH3(g) △H=" -92.4" kJ/mol据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是(填序号)。
①反应压强为20Mpa~50Mpa②500℃的高温③铁触媒作催化剂④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2T1(填>、=、<),判断的依据是: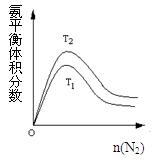
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2
H2(g)+CO2(g)平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为(填序号)
| A.其它条件不变温度T<900℃ | B.其它条件不变温度T>900℃ |
| C.充入一定量氖气 | D.使用高效催化剂 |
(Ⅲ)对于反应二,当升高温度时K2(填“增大”、“减小”或“不变”)。