回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4= Na+ + H+ + SO42-。在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填“酸性”、“中性”或“碱性”),c点所示的离子方程式为 。
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将 25℃(填“高于”或“低于”),Kw= ,在该溶液中由水电离出的c(H+)为 mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 = ,此溶液中各种离子的浓度由大到小的排列顺序为 。
(4)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为 。(用序号填空)
在恒温、恒容的1L密闭容器中,混合气体X、Y、Z的物质的量n与时间t 的关系如下表所示:X(g)+3Y(g) 2Z(g) △H <0
2Z(g) △H <0
| t/ min n/ mol |
0min |
2min |
4min |
6min |
8min |
| n(X) |
0.2 |
0.15 |
0.1 |
0.1 |
0.05 |
| n(Y) |
0.6 |
0.45 |
0.3 |
0.3 |
0.5 |
| n(Z) |
0 |
0.1 |
0.2 |
0.2 |
0.3 |
(1)第6min末改变了什么条件到达第8分钟的平衡状态: 。
(2)在相同温度下,若1L容器为体积可变的密闭容器,充入0.2molX 、0.6molY,达到平衡时n(Z)="bmol" ,则b 0.2(填“<”、“>”或“=”),平衡时容器的体积V = (用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数 (填“增大”、“减小”或“不变”)
在一定温度下,发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH_____0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为 。
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正 v逆(填“<”、“>”或“=”),平衡向 移动(填“正向”、“逆向”或“不移动”)。
合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
| A.ΔH>0,ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0,ΔS>0 | D.ΔH<0,ΔS<0 |
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s)ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+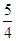 O2(g)===
O2(g)===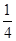 P4O10(s)ΔH 2=-738.5 kJ·mol-1
P4O10(s)ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
分一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)反应开始到平衡,用Z表示的反应速率为 mol·L-1·s-1,Y的转化率 。
(2)该反应的化学方程式为 。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是________________。
| A.t1时刻,增大了X的浓度 |
| B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 |
| D.t1时刻,使用了催化剂 |
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式__ ,该反应的△S____________0(填“>”或“<”或“=”),在_______________情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
| A.一定向正反应方向移动 |
| B.在平衡移动时正反应速率先增大后减小 |
| C.一定向逆反应方向移动 |
| D.在平衡移动时逆反应速率先减小后增大 |
(3)若反应的容器容积为2.0L,反应时间4.0 min,容器内氢气的质量减少了4.8g,在这段时间内CO2的平均反应速率为 。