有机化学中的反应类型较多,写出下列反应类型。
①由乙炔制氯乙烯 。
②乙烷在空气中燃烧 。
③乙烯使溴的四氯化碳溶液褪色 。
④乙烯使酸性高锰酸钾溶液褪色 。
⑤由乙烯制聚乙烯 。
⑥甲烷与氯气在光照的条件下反应 。
(12分)已知95℃时水的离子积Kw=1×10-12,25℃时Kw=1×10-14,回答下列问题:
(1)95℃时水的电离常数________(填“>”“=”或“<”) 25℃时水的电离常数.
(2)95℃纯水中c(H+)________(填“>”、“=”或“<”)c(OH-).
(3)95℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________.
在537℃、101KPa 时,往容积可变的密闭容器中充入2mol SO2、 1mol O2,此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:2SO2(g)+O2(g) 2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则平衡时,SO2的体积分数是,容器的体积为L。
(2)若温度和容器的容积不变,则平衡时的容器内气体的压强为KPa。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为101KPa。若a:b=2:1,则a=。
在t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) 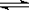 x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L。据此填写以下空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L。据此填写以下空白:
(1)v(B) =mol/(L·min), x的值=。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=;
(3)若继续向原平衡混合物的容器中通入少量氦气后(氦气和A、B、C都不反应),则下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动D.气体A的浓度会减小
在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB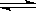 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_______;
(2)若A、C是气体,且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向方向移动;
(3)若B、C是气体,A是固体,增大A的浓度,平衡(填“正向移动”、“逆向移动”或“不移动”);
(4)若升高温度后,C的百分含量减小,则正反应是(填“吸热”或“放热”)反应。
(5)若该可逆反应达到平衡时加入催化剂,平衡(填“正向移动”、“逆向移动”或“不移动”);
完成并配平下列化学方程式□FeO + □HNO3→ □Fe(NO3)3 + NO↑+ □,当生成2mol NO时,转移的电子数为NA。