设NA表示阿佛加德罗常数,下列说法正确的是
| A.1mol CaC2中有3NA个离子 |
| B.1mol SiO2中含有2NA个共价键 |
| C.1L 1mol/L CH3COONa溶液中含NA个CH3COO—离子 |
| D.42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
醋酸溶液中存在电离平衡:CH3COOH(aq) H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是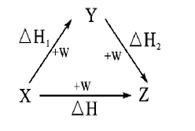
①C、CO②S、SO2③Na、Na2O④AlCl3、Al(OH)3
⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
下列说法正确的是
A 向饱和食盐水中通入HCl气体,看不到明显的现象
B将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小
C 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH=7
D.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
下列说法错误的是
| A.食醋用氢氧化钠溶液滴定,开始时溶液的PH通常变化缓慢,当接近完全反应时(即滴定终点),PH出现突变,称为滴定突跃。 |
| B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大。 |
| C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气 泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快。 |
| D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 |
漆酚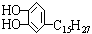 是我国特产漆的主要成分,漆酚不应具有的化学性质
是我国特产漆的主要成分,漆酚不应具有的化学性质
| A.可以跟NaOH溶液反应 | B.可以使酸性KMnO4溶液褪色 |
| C.可以跟NaHCO3溶液反应 | D.可以跟溴水发生取代反应 |