下列说法正确的是
| A.SO2能使FeCl3、KMnO4水溶液迅速褪色 |
| B.可以用澄清石灰水鉴别SO2和CO2 |
| C.硫粉在过量的纯氧中燃烧可以生成SO3 |
| D.少量SO2通入浓的CaCl2溶液能生成白色沉淀 |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.1 mol聚乙烯含有的原子数目为6NA |
| B.20℃时,1 mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
| C.1 mol甲基含10 NA个电子 |
| D.2.8 g乙烯和丙烯的混合气体中所含原子数为0.2NA |
W、X、Y、Z为四种短周期元素,X、Z同主族。已知X的原子半径大于Z的原子半径;Y的阳离子比W的阳离子氧化性强;Y的阳离子、W的阳离子、Z的阴离子具有相同的电子层结构。下列叙述正确的是
| A.原子半径:W>X >Y>Z |
| B.单质与盐酸反应速率:Y>W |
| C.X最低价氢化物的稳定性强于Z最低价氢化物 |
| D.W的氢氧化物的碱性强于Y的氢氧化物 |
以下物质:(1) 甲烷 (2) 苯 (3) 聚乙烯 (4) 聚乙炔 (5) 2-丁炔 (6) 环己烷 (7) 邻二甲苯 (8) 苯乙烯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是
| A.(3)(4)(5)(8) | B.(4)(5)(7)(8) | C.(4)(5)(8) | D.(3)(4)(5)(7)(8) |
以下实验能获得成功的是
| A.用酸性KMnO4溶液鉴别乙烯和乙炔 |
| B.将稀硫酸、稀硝酸和苯混合加热制硝基苯 |
| C.苯和硝基苯混合物采用分液的方法分离 |
| D.用CuSO4溶液除去由电石和水反应生成的乙炔气体中的杂质 |
某温度下,反应SO2(g)+ 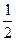 O2(g)
O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为
2SO2(g) + O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |