运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)图中A表示 ,E的大小对该反应的反应热有无影响? 。 (2)合成氨反应N2(g)+3H2(g)
(2)合成氨反应N2(g)+3H2(g)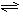 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH (填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)= mol·L—1·min—1
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH (填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)= mol·L—1·min—1 (3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。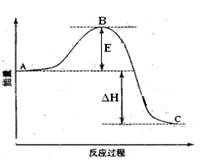
某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl- 三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
| 实验步骤 |
实验现象 |
结论 |
| 1、向盛放溶液的试管中加入足量。 |
有气泡产生 |
证明有CO32- |
| 2、继续向试管中加入足量溶液 |
有白色沉淀生成 |
证明有。 |
| 3、过滤,向滤液中加适量的溶液 |
有白色沉淀生成 |
证明有。 |
有三种固体物质和五种溶液:固体是铁粉、铜粉、氢氧化铜;溶液是CuSO4溶液、NaOH溶液、FeSO4溶液、H2SO4溶液、Na2SO4溶液。它们中的几种物质在常温下相互转化关系如下:
(1)溶液A+溶液C→固体甲+溶液D
(2)固体乙+溶液B→溶液E+氢气
(3)固体甲+溶液B→溶液C+水
试推断出溶液中A、B、C、D、E的化学式,写出固体甲、乙、丙的名称。
A、______________ B、______________ C、______________ D、_____________
E、______________甲、______________乙、_____________丙、_____________
同温同压下的氧气和氢气,两种气体的密度比为;若质量相等时,两种气体的体积比;如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积约是。
下列物质:①Br2 ②NaCl溶液 ③稀硫酸 ④CO2⑤Ba(OH)2晶体
⑥熔融KCl ⑦蔗糖
属于电解质的是(填代号,以下同),属于非电解质的是。
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)加入NaOH溶液进行的反应的离子方程式为 ___、
,向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。每生产0.27吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C + N2 AlN + CO(配平)
AlN + CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物