如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显示红色。则以下说法正确的是
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1﹕2﹕1﹕1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是
| A.HX、HZ、HY | B.HZ、HY、HX |
| C.HX、HY、HZ | D.HY、HZ、HX |
下列水溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H+)=1.0×10-7mol·L-1的溶液 |
| C.c(H+) =c(OH-) |
| D.pH=3的酸与pH=11的碱等体积混合后的溶液 |
根据下列有关图象,说法正确的是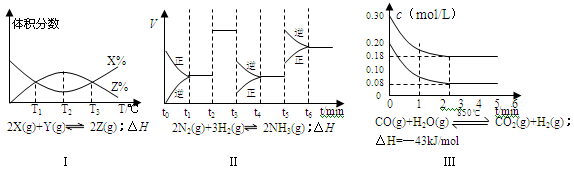
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
下列物质中能抑制水的电离且使溶液呈现出酸性的是:
| A.Na2CO3 | B.Al2(SO4)3 | C.K2SO4 | D.H2SO4 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
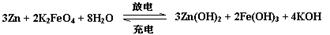 下列叙述错误的是:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |