向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量的不同,溶液M的组成也不同,若向M中加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计CO2的溶解)
| A.若OB=0,则形成溶液M所发生的离子方程式为OH-+CO2=HCO-3 |
B.若OB=BC,则溶液M为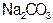 溶液 溶液 |
C.若OB>BC,则溶液M中大量存在的阴离子为 和 和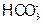 |
D.若30B=BC,则溶液M中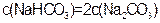 |
工业生产水煤气的反应为:C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是( )。
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l) ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是( )。
| A.简单离子半径大小顺序:r(T)>r(X)>r(Y) |
| B.T与Z的最高正化合价相等 |
| C.室温下,单质Y不能与浓硫酸反应 |
| D.用电解法可制得T、X、Y的单质 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是( )。
| W |
X |
|
| Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性弱于Y
D.YZ2分子中各原子的最外层均满足8e-稳定结构
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是( )。
A.离子半径:D+>C-
B.EA2是光导纤维的主要成分
C.A和B可以形成原子个数比1∶1的化合物
D.以上元素中形成的最高价氧化物对应的水化物的酸性最强的是C
下列排列顺序正确的是( )。
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Cs>Na
| A.①③ | B.②④ | C.①④ | D.②③ |