工业上为了除去铝材表面的自然氧化膜,常常将铝材浸入装有NaOH溶液的碱洗槽中。 碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3 b.CO2 c. NaOH d.HNO3
(本题共12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀盐酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③两个实验有关的离子方程式:
②________________________________;③_____________________________________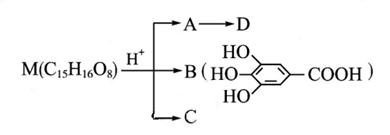
燃料电池是一种新型的无污染、无噪音、高效率的发电设备,是一种很有发展潜力的新能源,它主要由燃料、氧化剂、电极和电解质组成,燃料电池的结构和传统电池一样具有正负电极,正负电极被电解质分隔,它以还原剂(用氢作燃料)为负极反应物,以氧化剂(如空气中的氧气等)为正极交换物,在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
(1)燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:负极______________;正极______________.
(2)氢氧燃料电池可作为载人航天器的首选电池,一个重要原因是它在产生持续电流的过程中生成的产物是水,这正好解决航天员的饮水问题,航天员饮用这些合成水通过消化系统,大部分在被___________吸收.
2001年诺贝尔化学奖被美国的诺尔斯、沙普雷斯和日本的野依良治获得,以表彰他们发现某些被称为手征性的分子可以用来加速并控制化学反应的创造性工作.在有机物分子中,若某碳原子连接四个不同的原子或基团,则这种碳原子称为“手征性碳原子”.例如: 中*C就是“手征性碳原子”.含“手征性碳原子”的物质通常具有不同的光学特征(称为光学活性).
中*C就是“手征性碳原子”.含“手征性碳原子”的物质通常具有不同的光学特征(称为光学活性).
(1)据报道最新合成的有机物A为: 具有光学活性,若要使A失去光学活性,可采用的方法有(最少列举三种方法):
具有光学活性,若要使A失去光学活性,可采用的方法有(最少列举三种方法):
(2)某链烃B的分子式为 ,在B的各种结构(不考虑
,在B的各种结构(不考虑 结构)中,含有“手征性碳原子”,且与足量
结构)中,含有“手征性碳原子”,且与足量 加成反应后仍具有光学活性的有机物有五种,已知其中三种的结构简式为:
加成反应后仍具有光学活性的有机物有五种,已知其中三种的结构简式为:
① 
② 
③ 
则另两种的结构简式为:
④______________________________________,
⑤______________________________________.
现有化合物甲: 乙:
乙:
丙:
(1)请写出乙中含氧官能团的名称:________,________.
(2)请判别上述哪些化合物互为同分异构体:
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可).
(4)请按酸性由强到弱排列甲、乙、丙的顺序:________、________、________.
利用示踪原子可以研究化学反应.比如乙酸乙酯与水反应,生成醋酸和乙醇,反应方程式为:
乙酸乙酯 水 醋酸 乙醇
那么,水解过程是从甲处断开还是从乙处断开呢?试分析说明如何通过示踪原子的方法来确定化学反应的过程.