“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2沸点11℃,是一种黄绿色的气体,易溶于水。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。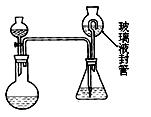
 某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题: (1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是: 。
(1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是: 。 (2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右)
(2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右) 试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
(Ⅰ)NaClO2与盐酸反应生成ClO2(还原产物为Cl-),该反应的化学 方程式为:
方程式为:
;ClO2通入锥形瓶与酸性碘化钾溶液反应, 二氧化氯被还原为氯离子,该反应的离子方程式为: 。
二氧化氯被还原为氯离子,该反应的离子方程式为: 。 (Ⅱ)装置中玻璃液封管的作用是: ;如何确定烧瓶中
(Ⅱ)装置中玻璃液封管的作用是: ;如何确定烧瓶中 的二氧化氯全部被锥形瓶中的液体吸收 。
的二氧化氯全部被锥形瓶中的液体吸收 。 (Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为
(Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为  (用m、c、V表示)。
(用m、c、V表示)。
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是_________________。
(2)方案二:按下图装置进行实验。并回答以下问题: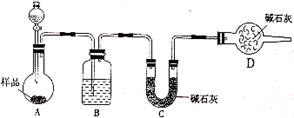
①分液漏斗中应该装___________(填“盐酸”或“稀硫酸”),D装置的作用是_________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_____________;
②若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥后的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(保留一位小数)。
某研究性小组用0.20 mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞)。
请回答:
(1)下图表示50 ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为20,此时滴定管中液体的体积mL。
(2)滴定过程中,眼睛始终注视 ,直到锥形瓶中液体的颜色……。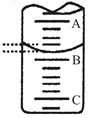

(3)同学们进行了三次实验,每次取白醋 20.00 ml, 实验结果记录如上表:请计算白醋的物质的量浓度为_________(保留两位有效数字)。
(4)操作时用白醋润洗锥形瓶,对滴定结果产生的影响是________(填“偏大”或“偏小”或“无影响”。下同)。若用白醋润洗酸式滴定管,对滴定结果产生的影响是。
(5)若滴定终点时测得pH=7。下列离子浓度的比较正确的是。
| A.c(Na+)>c(CH3COO—) | B.c(Na+)<c(CH3COO—) |
| C.c(Na+)=c(CH3COO—) | D.不能确定 |
某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答: 
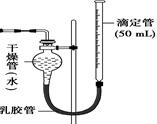
图Ⅰ图Ⅱ
(1)装置图Ⅰ中放有硫酸的仪器名称是。
(2)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 。
(3)实验结束后,得到的结论是。
(4)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是。
虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应所产生的所有气体产物。请填写下列空白。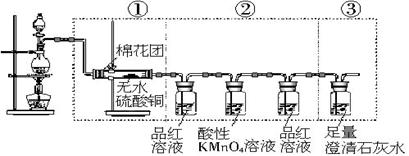
(1)如果将图示装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可检验出来的物质是_____;不能检验出来的物质是______。
(2)如果将仪器的连接顺序变为①、③、②,则可检验出来的物质是_____;不能检验出来的物质是_______。
(3)如果将仪器的连接顺序变为②、③、①,则可检验出来的物质是______;不能检验出来的物质是________
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。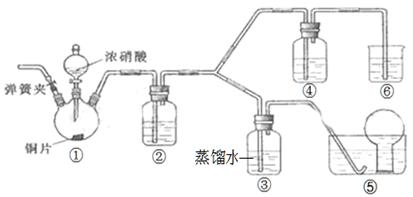
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及CO2。
已知氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是、
、。
(2)滴加浓硝酸之前,需打开弹簧夹,通入一段时间的CO2,其目的是
。
(3)装置①中发生反应的离子方程式是。
(4)装置②的作用是,发生反应的化学方程式是。
(5)该小组得出的结论依据的实验现象是。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是。(可多选)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氧气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化