有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1:8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol 电子 |
| D.若把该反应设计为原电池,则负极反应为Fe2+- e- = Fe3+ |
下列有关化学用语的表述正确的是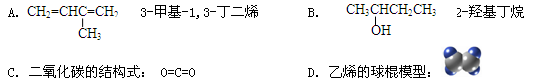
难溶于水的金属氧化物是
| A.SiO2 | B.CO2 | C.Na2O2 | D.MnO2 |
向22.4 g Fe2O3、Cu的混合物中加入0.5 mol/L的硫酸溶液600 mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用CO在高温下还原相同质量的原混合物,固体减少的质量可能为
| A.1.6g | B.4.8g | C.5.6g | D.6.4g |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是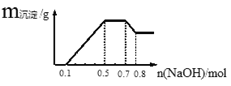
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| C.溶液中n(NH4+)=0.2mol |
| D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
明矾与氢氧化钡溶液反应,对应的离子方程式正确的是
| A.0.2 mol明矾与0.3 mol的氢氧化钡溶液混合2Al3++3SO42-+3Ba2++6OH-→2Al(OH) 3↓+3BaSO4↓ |
| B.0.2 mol明矾与0.2 mol的氢氧化钡溶液混合Al3++SO42-+Ba2++4OH-→AlO2-+BaSO4↓+2H2O |
| C.一定量的明矾溶液中加入氢氧化钡溶液,生成沉淀的质量最多Al3++2SO42-+2Ba2++4OH-→AlO2-+2BaSO4↓+2H2O |
| D.一定量的明矾溶液中加入氢氧化钡溶液,生成沉淀的物质的量最多Al3++2SO42-+2Ba2++3OH-→Al(OH) 3↓+2BaSO4↓ |