二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是
下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)。
(2)倒入NaOH溶液的正确操作是(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 3 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
四氯化硅是粗硅精炼中的中间产物,熔点-70℃,沸点57.6℃,在潮湿空气中水解生成硅酸和氯化氢。某兴趣小组在实验室里通过下图所示装置制取少量四氯化硅: 
如何检验上图气体发生装置的气密性: ______________________
A装置中发生反应的离子方程式为: ________________________
A装置中玻璃实验仪器名称为(写出两种即可):_______和_______
B中的液体为:______________F中碱石灰的作用为:① __________②________
先加热图中哪个装置:__________________原因:________________________
若实验中用12mol·L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量
总是小于0.03mol,试分析可能存在的原因是:① __________② _________
(每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
请整理并完成实验报告:
(1)实验目的:。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器:、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
| 实验序号 |
实验现象 |
化学方程式 |
| ① |
有气体产生,溶液变成浅红色 |
|
| ② |
生成浅黄色沉淀 |
Na2S+Cl2=2NaCl+S↓ |
| ③ |
2Na+2H2O=2NaOH+H2↑ |
|
| ④ |
剧烈反应,迅速产生无色气体 |
Mg+2HCl=MgCl2+H2↑ |
| ⑤ |
反应不十分剧烈,产生无色气体 |
2Al+6HCl=2AlCl3+3H2↑ |
| ⑥ |
开始时生成白色胶状沉淀,继而沉淀消失 |
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
(4)实验结论:。
(5)请用原子结构的知识简单解释上述结论:。
(每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题: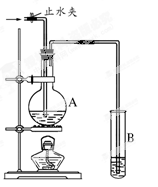
(1)若向A中通入足量的二氧化硫气体,A中的现象是。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是。
(每空2分,共14分)在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于水的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1=s,在答题卷的方框内画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率的结论是。
(3)t1(填“>”或“<”)t4,原因是。t2t3(填“>”或“<”),原因是。