现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平 。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时还欠缺的仪器是 。
(2)经计算,需浓H2SO4的体积为 mL(精确到0.1)。
(3)配制过程有以下操作:
A.移液
B.量取
C.洗涤
D.定容
E.稀释
F.摇匀
其正确的操作顺序应是 (填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
A、定容时,俯视标线
B、稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
C、摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
D、转移前,容量瓶中含有少量蒸馏水
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)= 。
两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。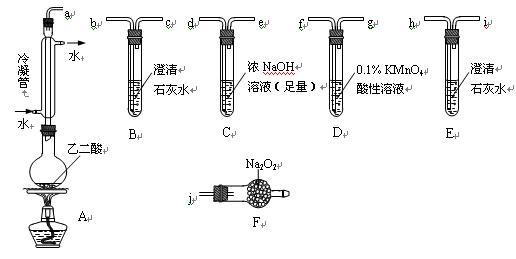
(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有____________;装置C的作用是________________________;E中溶液变浑浊,D中的现象是________________________,证明分解产物有____________。
②乙二酸受热分解的化学方程式为____________________________________________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________________。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是____________________________________;实验后用F中的固体进行验证的方法是____________________________________(可另选试剂)。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示。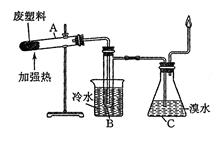
加热聚丙烯塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中的最终残余物为________;在试验中大试管管口倾斜向上的原因是___________。
(2)试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有_____种。
(3)锥形瓶C中观察到的现象是_______________;经溴水充分吸收再干燥后,剩余两种气体的成份为____________,其平均相对分子质量为_____________。
(12 分)实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,请根据实验回答下列问题。
(1)其制备原理可用化学方程式表示为:,浓硫酸的作用是。
反应装置中除了加入乙醇和浓硫酸外,还需要加入(填物质名称)
(2)请从以下装置中选择该反应的反应装置()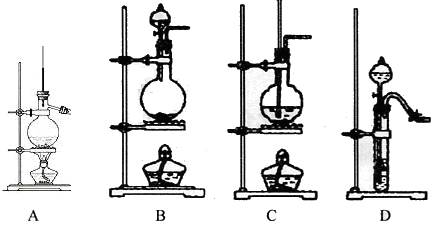
(3)反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过下图实验装置。(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用。)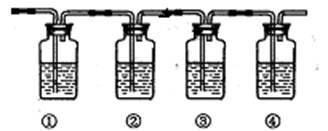
A.①②中盛放的试剂分别为①;②;(填试剂名称)
B.能说明二氧化硫气体存在的现象是。
C.能确认含有乙烯的现 象是。
象是。
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下: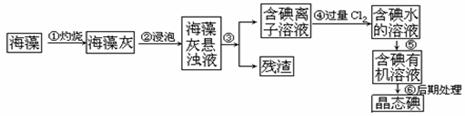
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③_________,步骤⑤____________
(2)写出步骤④对应反应的离子方程式 _____________________________
(3)步骤④中若不用氯气,可以选择滴加稀硫酸,再加入H2O2,则反应的离子方程式________
(4)提取碘的过程中,可选择的有机试剂是_______________
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的两种玻璃仪器是____________________________________________
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处(1处):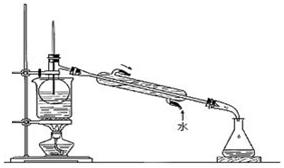
(7)请设计出一种检验提取碘后的水溶液中是否还含有单质碘的简单方法。
化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。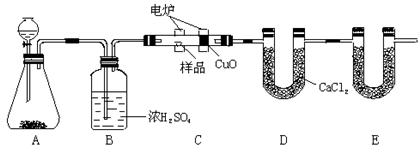
回答下列问题:
(1)A装置中分液漏斗盛放的物质是,写出有关反应的化学方程式:。
(2)C装置(燃烧管)中CuO的作用是。
(3)写出E装置中所盛放物质的名称,它的作用是。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为。