(8分)
(1)6.20g 白磷(P4)在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为________________L.上述燃烧生成氧化物溶有于水配成50.0mLH3PO4溶液,该溶液的物质的量浓度为____________ mol ·L-1
(2)含0.300molH3PO4溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g水,该难溶盐的化学式可表示为____________。
在稀氨水中存在平衡:NH3+H2O NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH 、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3),c(H+),PH值。
、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3),c(H+),PH值。
(2加入少量NaOH固体时,c(NH ),c(OH-),PH值。
),c(OH-),PH值。
(3)加入NH4Cl晶体时,c(NH ),c(OH-)。
),c(OH-)。
将0.1 mol的镁、铝混合物溶于100mL 2mol·L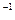 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L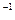 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)
(1)若在滴加NaOH溶液的过程中沉淀质量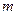 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当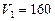 mL时,则金属粉末中
mL时,则金属粉末中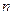 (Mg)=mol,
(Mg)=mol,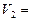 mL。
mL。
(2)①要配制100 mL 2mol·L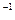 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有。
②下列操作会使所配的溶液浓度偏小的是()(填代号)
| A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内 |
| B.稀释硫酸所用的小烧杯未洗涤 |
| C.定容时俯视液面 |
| D.用蒸馏水洗涤后的容量瓶未干燥 |
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
在一定条件下有以下转化关系,已知A、B、C中均含有同种元素。请回答下列问题。
 |
(1)若D为日常生活中最常见的金属单质之一,且以上反应均为氧化还原反应;除以上四种物质外,整个转化过程中没有其它物质参与或生成。
①构成D单质的元素在周期表中的位置是;
②反应③的离子方程式。
③试叙述检验物质B中阳离子的实验方法。
(2)若无反应③的转化过程,C为红棕色气体,试分析:
①A、B、C中含有的共同元素为(写名称):。
②C与H2O反应的化学方程式为。
③若A为化合物时其电子式为。
有A、B、C、D四种可溶性盐,其阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、Cl-、SO42-、CO32-中的某一种,每种离子只存在于一种物质中,不能重复出现。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,可见到A溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,则B溶液有白色沉淀产生,C溶液有无色无味气体产生。
根据以上实验可推知
①四种盐的化学式分别是:A,B,C,D。
②写出B溶液产生白色沉淀的离子方程式。
③写出C溶液有无色无味气体产生的离子方程式。
在烷烃分子中的基因:—CH3,—CH2—,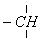
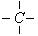 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4表示,例如:
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4表示,例如: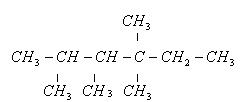
分子中n1="6" , n2="1" , n3="2" , n4=1试根据不同烷烃的组成和 结构,分析出烷烃(除甲烷外)中各原子数的关系。
结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数为no,no与n1、n2、n3、n4、的关系是:
n0=或n0=。
(2)四种碳原子数间的关系为。
(3)若某分子中n2=n3=n4= 1则该分子的结构简式可能是。
1则该分子的结构简式可能是。