(1)写出这五种元素的名称:A____,B____,C____, D____,E____。
(2)写出AB2、CB2、AD2的化学式:____、____、____。
(3)C、D、E最高价氧化物的水化物的化学式为____、____、____,其中酸性最弱的是____,其与烧碱溶液反应的离子方程式为:____.
(共14分 )
(1)甲烷的结构式是。乙烯的电子式是。将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是______。
(2)在烷烃分子中,每增加一个碳原子,1mol烷烃完全燃烧需要多消耗氧气(填字母)________。
A.1molB.1.5mol C.2mol D.2.5mol
(3)乙醇分子内有四种不同的化学键(如图) ,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
A.乙醇在热的铜丝催化下发生氧化反应:,断裂(填序号)化学键;
B.乙醇中投入钠粒冒气泡:,断裂(填序号)化学键。
分现有以下物质: ①NaCl晶体 ②干冰 ③熔融的KNO3 ④石墨
⑤BaSO4固体 ⑥蔗糖 ⑦酒精,请回答以下问题(填序号):
(1)能导电的是_________;
(2)属非电解质的是_________;
(3)属于电解质的是________;
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)甲中SO42-移向极(填“铝片”或“镁片”)。写出甲中正极的电极反应式__________。
(2)乙中负极为________,总反应的离子方程式:_________________。此反应中氧化剂和还原剂的物质的量之比为。
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法_______(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案_____________(如可靠,此空可不填)。
(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期非金属元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13;
②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。
试根据以上叙述回答:
(1)B单质的电子式为,画出C元素的原子结构示意图;
(2)下列环境问题与B与C形成的化合物有关的是;
A.温室效应 B.光化学烟雾C.酸雨D.PM2.5
(Ⅱ)现有下列短周期元素相关性质的数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
| 最高正化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
| 最低负化合价 |
-2 |
-3 |
-1 |
-3 |
试回答下列问题:
(1)元素⑤在周期表中的位置;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是(写化学式);
(4)以下叙述正确的是。
A.氢化物的沸点为④<⑦B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快 D.最高价氧化物对应水化物的碱性③>⑥
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g)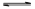 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题: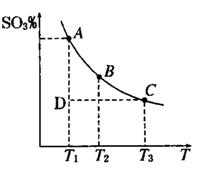
①2SO2(g)+O2(g)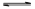 2SO3(g)的△H0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡移动(填“向左”“向右”或“不移动”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1K2;温度为T1时,反应进行到状态D时,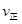
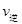 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
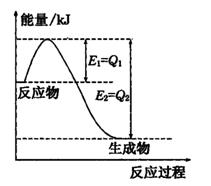
①如图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是____________、____________
②请写出工业合成氨的热化学方程式:(△H的数值用含字母Q1、Q2的代数式表示)