铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
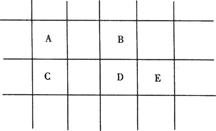
(1)写出这五种元素的名称:A____,B____,C____, D____,E____。
(2)写出AB2、CB2、AD2的化学式:____、____、____。
(3)C、D、E最高价氧化物的水化物的化学式为____、____、____,其中酸性最弱的是____,其与烧碱溶液反应的离子方程式为:____.
(1)将青海昆仑玉的化学组成用氧化物的形式表示______________。
(2)经测定青海昆仑玉的各组分的质量分数(%)为CaO 13.8,MgO 14.52,FeO 10.08,SiO2 58.8,H2O 2.8,则该玉是______石。

(1)反应②中,氧化剂和还原剂的质量比: 。
(2)B、D、E形成原子晶体的熔点由高到低的顺序是 。
(1)A、B、C的元素名称A______;B_______;C________
(2)A、B的最高价氧化物的水化物的化学式为(按酸性由强到弱顺序排列)__________
(3)A、B、C的氢化物的化学式为(按稳定性由强到弱顺序排列)_________________
(4)B的氧化物与A的单质反应的化学方程式为:_________________________
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的三个棉球(如图所示)由左端导入Cl2,在B处加热,可观察到A处棉球呈__________色,B处棉球呈______________色,C处棉球呈___________________色。
待试管冷却后,在B、C之间的玻璃壁上有__________色的___________,这是因为_______。