某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是 ( )
| A.镁粉只直接与溴水中的溴反应 |
| B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 |
| D.镁粉在水的催化下与溴发生反应 |
下列说法与盐的水解有关的是 ( )
①明矾可以傲净水剂;
②实验室配制FeCl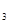 溶液时,往往在FeCl
溶液时,往往在FeCl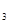 溶液中加人少量的盐酸;
溶液中加人少量的盐酸;
③用NaHCO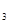 和A1
和A1 (SO
(SO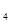 )
)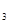 两种溶液可作泡沫灭火剂;
两种溶液可作泡沫灭火剂;
④在NH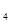 Cl溶液中加入金属镁会产生氢气;
Cl溶液中加入金属镁会产生氢气;
⑤草木灰与氨态氮肥不能混合施用;
⑥实验室盛放Na CO
CO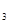 溶液的试剂瓶应用橡皮塞;
溶液的试剂瓶应用橡皮塞;
⑦纯碱溶液去油污;
| A.①③⑥ | B.②③⑤ | C.③④⑤ | D.全部有关 |
下列各离子方程式属于水解反应,且可使溶液呈酸性的是 ( )
A.HS +H +H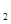 0 0 H H O O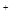 +s +s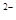 |
B.NH +2H +2H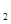 O O NH3·H NH3·H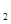 O+H O+H O+ O+ |
C.HCO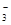 +OH +OH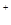  CO CO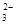 +H +H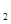 O O |
D.CO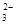 +2H +2H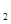 O O H H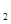 CO CO +2OH +2OH |
在一定条件下,反应N 十3H
十3H
 2NH3,在2L密闭容器中进行,5main内氨的质量
2NH3,在2L密闭容器中进行,5main内氨的质量
增加了1.7g,则反应速率为 ()
A.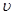 (H
(H )=0.03mol/(L·min) B.
)=0.03mol/(L·min) B.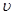 (N
(N )=0.02mol/(L·min)
)=0.02mol/(L·min)
c.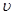 (NH
(NH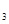 )=0.17g/(L·mitt) D.
)=0.17g/(L·mitt) D.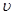 (NH
(NH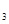 )=O.O1mol/(L·min)
)=O.O1mol/(L·min)
用铜片、银片、Cu(NO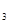 )
) 溶液、AgNO
溶液、AgNO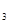 溶液、导线和盐桥(装有琼脂-KNO
溶液、导线和盐桥(装有琼脂-KNO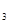 的u型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
的u型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag +e
+e =Ag
=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.②④ B.②③ c.①② D.③④
下列关于反应热的表述正确的是 ( )
A.当△H<0时,表示该反应为吸热反应
B.需要加热才能进行的反应是吸热反应
c.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1mO1NaOH分别和1mo1CH COOH、1mO1HNO
COOH、1mO1HNO 反应放出的热量:CH
反应放出的热量:CH COOH<HNO
COOH<HNO