一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) ="=" 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) ="=" 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
乙烯和苯是两种重要的化工原料,现有同学分别取这两种物质进行实验:
| 实验步骤 |
实验现象 |
解释及相关反应方程式 |
| 将乙烯通入溴水中 |
发生了反应(填反应类型),反应方程式: |
|
| 将苯与溴水混合振荡,静置 |
溴在苯中的溶解度比在水中的溶解度;苯的密度比水。 (填“大”或“小”) |
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中各电极的电极反应式:负极:;正极: 。
(3)C中被腐蚀的金属是,正极反应。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。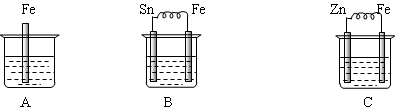
(教材变式题)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编号 |
改变的条件 |
化学反应速率 |
| ① |
降低温度 |
|
| ② |
增大O2的浓度 |
|
| ③ |
使用V2O5作催化剂 |
|
| ④ |
压缩体积 |

现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
⑴当加入50mLBa(OH)2溶液时,发生反应的离子方程式为,所得溶液中的溶质是,其物质的量浓度为mol·L—1;
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液中溶质,则该溶质物质的量浓度为 mol·L-1。
在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。①此混合物中CO和CO2的物质的量比是,②CO的体积分数是,③CO的质量分数是,④C和O的原子个数比是,⑤混合气体的平均摩尔质量是。