下列判断正确的是
| A.酸性氧化物都能与水反应生成对应的酸 |
| B.晶体中一定存在化学键 |
| C.碱性氧化物一定是金属氧化物 |
| D.非金属氧化物一定是酸性氧化物 |
铁和氧化铁的混合物共x mol,加盐酸后固体全部溶解,共收集到ymol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A. (x+y)mol (x+y)mol |
B.(x-y) mol | C. (x-y)mol (x-y)mol |
D.(x+y) mol |
下列推断或表述正确的是
A.在醋酸溶液的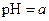 ,将此溶液稀释1倍后,溶液的 ,将此溶液稀释1倍后,溶液的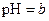 ,则 ,则 |
| B.向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C.0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+ c(K+)= c(OH-)+ c(X-) |
| D.0.2 mol•L-1盐酸与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液pH为1 |
关于下列四个图像的说法中正确的是
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0 CO2(g)+H2(g)”中的△H大于0 |
| B.图②是在以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D.图④中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是()
| A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量二氧化碳的离子方程式: 2ClO-+CO2+ H2O |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
下列各项内容中,排列顺序正确的是()
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②相同物质的量浓度的下列溶液中c(NH+4):(NH4)2 SO4 >(NH4)2 CO3> NH4Cl
③微粒半径:K+>S2->F- ④给出质子的能力:CH3COOH>C2H5OH>H2O
④给出质子的能力:CH3COOH>C2H5OH>H2O
⑤沸点:H2Se> H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |