能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:
CO(g)+2H2(g) CH3OH(g);△H
CH3OH(g);△H
下图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、< 或 = ”)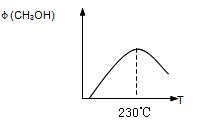
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中Cu极为 极;写出b极的电极反应式 ,当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为  L。
L。 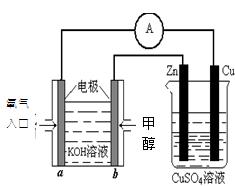
| 难(微)溶物 |
溶度积常数(Ksp) |
BaSO 4 4 |
1×10-10 |
| BaCO3 |
2.6×10-9 |
| CaSO4 |
7×10-5 |
| CaCO3 |
5×10-9 |
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
具体做法是用饱和纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ 
 mol·L-1
mol·L-1
标准状况下,①6.72 LCH4②3.01×1023HCl分子③0.2mol NH3,这三种气体按质量由大到小排列的顺序是(填物质的数字代号,下同),按氢原子数由少到多排列的顺序是,密度由大到小排列的顺序是。
下列九种物质:
①水②空气③铁④二氧化碳⑤熟石灰[Ca(OH)2]⑥胆矾(CuSO4·5H2O)⑦碱式碳酸铜[Cu2(OH)2CO3]⑧硫酸钠(Na2SO4)⑨盐酸中,属于混合物的是(填对应的数字代号),属于氧化物的是,属于盐的是,
[化学——选修有机化学基础]
目前世界上已证明“达菲”Tamiflu是治疗禽流感和甲型H1N1流感的一个良方。达菲是以从八角提取的莽草酸为原料,再经过十几步反应得的
(1)下列有关莽草酸的说法中正确的是( )
①分子式为C7H10O5②不溶于水③能使FeCl3溶液显紫色④能使溴的四氯化碳溶液褪色⑤1mol莽草酸可与4mol钠反应⑥1mol莽草酸与足量的 NaHCO3溶液反应可产生标准状态下的气体22.4L⑦多吃八角可以防治禽流感。
(2)莽草酸中含有的官能团有(写名称)
(3)1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量比为
(4)莽草酸可与C2H5OH反应,写出反应的化学方程式。
[化学—选修物质结构与性质]
下面的表格是元素周期表的一部分,其中的字母对应不同的元素。(用元素符号回答问题)
| A |
|||||||||||||||||
| M |
Q |
R |
|||||||||||||||
| E |
B |
D |
|||||||||||||||
| G |
L |
C |
|||||||||||||||
请回答下列问题:
(1)M、Q、R按第一电离能由小到大的顺序为。
(2)Q元素的氢化物分子的立体结构呈形,该分子属于分子(填“极性”或“非极性”),中心原子呈杂化方式;
(3)写出L基态原子核外电子排布式,L的硫酸盐溶液中加入过量Q的氢化物的水溶液可得深蓝色溶液,请写出该溶液显深蓝色的微粒的化学式。
(4)已知AMQ分子是直线型分子,则其分子中含有σ键和π键的数目之比为。
(5)试比较Q、B和C的氢化物沸点高低及热稳定性并说明理由。
㈠下列物质属于非电解质的是,属于弱电解质的是
①氨水②SO2③CI2④甲酸⑤BaSO4 ⑥CH3OH⑦H2O⑧NaHCO3⑨AI2O3
㈡有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法: